Polyamide
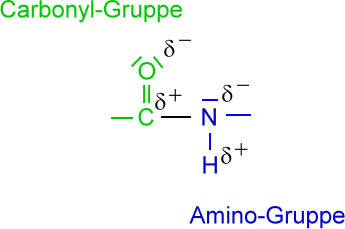
Polyamide sind Makromoleküle, die Amidbindungen enthalten. Diese Amidbindungen sind chemisch identisch mit den Peptidbindungen der Peptide bzw. Proteine. So gesehen sind z.B. Haare, Wolle, Seide und Eiweiß natürliche Polyamide.
Eigenschaften
Polyamide (PA) haben eine glatte Oberfläche, sind sehr abriebfest, besitzen eine hohe Zugfestigkeit und sind unzerbrechlich. Sie besitzen eine gute Chemikalienbeständigkeit. So sind sie z.B. gegen Schmier- und Kraftstoffe bei Temperaturen bis über 150 °C beständig.
Bei den synthetisch hergestellten Polyamiden (PA) handelt es sich um Thermoplaste. Deshalb lassen sie sich gut aus der Schmelze verarbeiten.
Verarbeitung
Kunstfasern werden nach dem Schmelzspinnverfahren verarbeitet. Hierbei wird das Polyamid-Granulat geschmolzen und anschließend durch Spinndüsen gepresst. Danach werden die erstarrenden Fäden gebündelt und durch Zug gestreckt. Bei diesem sogenannten Verstrecken ordnen sich die Makromoleküle in einigen Bereichen parallel an und bilden durch "Wasserstoffbrücken" kristallähnliche Bereiche aus, die den Kunststofffasern eine größere Festigkeit geben. Ein verstrecktes Polyamid ist also ein teilkristalliner Kunststoff.
Verwendung

 Die ersten brauchbaren synthetischen Kunstfasern waren Polyamide. Sie zählen heute noch zu den mengenmäßig bedeutsamsten Kunstfasern. Wichtige Vertreter sind Nylon und Perlon. Doch nicht nur bei den Textilien findet man Polyamide. Aus diesem Kunststoff bestehen auch Angelschnüre, Saiten von Streich- und Zupfinstrumenten, chirurgisches Nahtmaterial, Dübel, Kabelbinder, Zahnräder, Zahnbürsten-Borsten, Kraftstoffleitungen, Ölwannen uvm.
Die ersten brauchbaren synthetischen Kunstfasern waren Polyamide. Sie zählen heute noch zu den mengenmäßig bedeutsamsten Kunstfasern. Wichtige Vertreter sind Nylon und Perlon. Doch nicht nur bei den Textilien findet man Polyamide. Aus diesem Kunststoff bestehen auch Angelschnüre, Saiten von Streich- und Zupfinstrumenten, chirurgisches Nahtmaterial, Dübel, Kabelbinder, Zahnräder, Zahnbürsten-Borsten, Kraftstoffleitungen, Ölwannen uvm.
Bildquelle rechts: Nylonstrümpfe, Africa-Studio - Fotolia.com
Identifikation
Polyamid brennt mit gelboranger Flamme. Der brennende Kunststoff schäumt etwas und bildet braunschwarze Ränder und tropft in Fäden ab. Bläst man die Flamme aus, so riecht der Rauch leicht nach Horn. Bei der Schwelprobe wird der Kunststoff braun und bildet braunen Qualm. Die Dämpfe reagieren alkalisch.
PA schwimmt nicht in Wasser. Polyamid löst sich etwas in Ameisensäure. Damit lässt sich Polyamid auch kleben.
Hergestellt werden die Polyamide durch Polykondensation.
Folgende Monomere werden in der Regel für die Synthese verwendet:
- Aminosäuren
- Diamine (Monomer mit zwei Amino-Gruppen)
- Dicarbonsäuren (Monomere mit zwei Carboxy-Gruppen) bzw. Halogenide der Dicarbonsäuren
- Lactame (ringförmige Moleküle, die innerhalb des Ringes eine Amidbindung besitzen
Nylon
Link: Entdeckung des Nylons

Verwendet man für die Synthese von Nylon Adipinsäure (1,6-Hexandisäure), so spaltet sich bei der Polykondensation Wasser ab. Dies wird hier beim Reaktionsschema 1 in Skelettformelschreibweise links erkennbar.

Man kann für die Nylonsynthese aber auch Adipinsäuredichlorid (Hexansäuredichlorid) verwenden. Beim Reaktionsschema 2 in Halbstrukturformelschreibweise wurde Sebacinsäuredichlorid (Decansäuredichlorid) benutzt. Durch Zugabe von Natronlauge kann das chemische Gleichgewicht zugunsten der Polyamidbildung verschoben werden, da hierbei eine Neutralisationsreaktion vonstatten geht [1], wobei durch das Entfernen des Reaktionsproduktes natürlich sowieso das chemische Gleichgewicht zugunsten des Reaktionsproduktes verschoben wird.
---------------------------------
[1] Kölner Modell, Experimente zu Makromolekülen, 5. überarb. Auflage Februar 2006