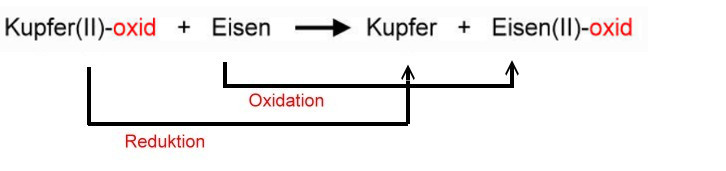
Reduktion von Kupfer(II)-oxid mit Eisen
 Erhitzt man ein graues Gemisch aus der schwarzen Verbindung Kupfer(II)-oxid und dem Element Eisen, so glüht das Gemisch hell auf. Nach dem Abkühlen erkennt man deutlich ein kupferfarbenes, rötliches Metall, eben Kupfer, und einen dunklen anderen Stoff (Eisenoxid).
Erhitzt man ein graues Gemisch aus der schwarzen Verbindung Kupfer(II)-oxid und dem Element Eisen, so glüht das Gemisch hell auf. Nach dem Abkühlen erkennt man deutlich ein kupferfarbenes, rötliches Metall, eben Kupfer, und einen dunklen anderen Stoff (Eisenoxid).


 Offensichtlich konnte Eisen dem Kupferoxid den Sauerstoff entreißen, so dass elementares Kupfer übrig blieb. Eisen ist hier also ein Reduktionsmittel und wurde selbst zum Eisenoxid oxidiert.
Offensichtlich konnte Eisen dem Kupferoxid den Sauerstoff entreißen, so dass elementares Kupfer übrig blieb. Eisen ist hier also ein Reduktionsmittel und wurde selbst zum Eisenoxid oxidiert.
 Wie interpretiert der Chemiker diese chemische Reaktion auf der Teilchenebene?
Wie interpretiert der Chemiker diese chemische Reaktion auf der Teilchenebene?
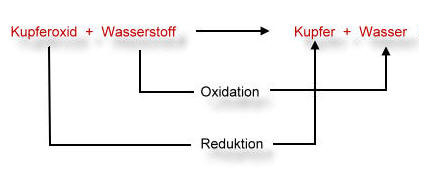
Reaktionsschema in Worten (Wortreaktionsschema):
Die römische Zwei bedeutet, dass das entsprechende Metall zwei-wertig ist.
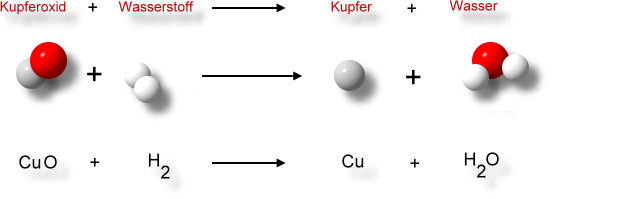
Reaktionsschema auf der Teilchenebene:
Reaktionsschema in Symbolformelschreibweise:
Reaktionsschema in Ionenformelschreibweise:
Im Detail:
Kupfer-Ionen nehmen jeweils zwei Elektronen auf und werden dadurch zu Kupfer-Atomen.
Eisen-Atome geben jeweils zwei Elektronen ab und werden dadurch zu Eisen-Ionen.

Aufnahme von Elektronen = Reduktion
(Kupfer-Ionen werden also in diesem Beispiel reduziert).
Abgabe von Elektronen = Oxidation
(Eisen-Atome werden also in diesem Beispiel oxidiert).
Bei der Reaktion laufen also zwei Prozesse gleichzeitig ab:





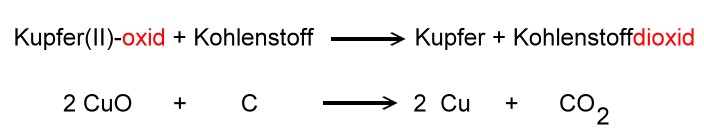
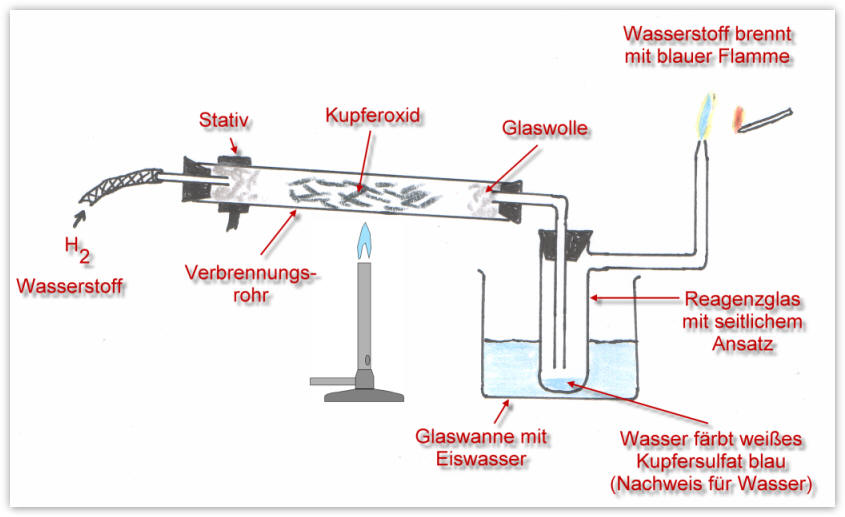
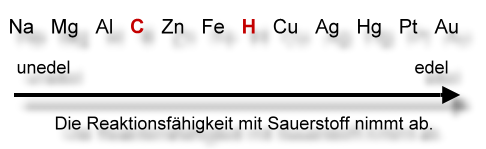
 Doch welche Stoffe können den Oxiden den Sauerstoff entreißen?
Doch welche Stoffe können den Oxiden den Sauerstoff entreißen?