Bei vielen Reaktionen kann man nicht auf Anhieb erkennen, welche Stoffe oxidiert und welche reduziert werden bzw. wo Elektronenübergänge stattfinden. Deshalb hat man die sogenannten Oxidationszahlen eingeführt.
Definition nach IUPAC:
Die Oxidationszahl (oder auch Oxidationsstufe) eines Elements in irgend einer chemischen Einheit gibt die Ladung an, die ein Atom des Elements haben würde, wenn die Elektronen jeder Bindung an diesem Atom dem jeweils stärker elektronegativen Atom zugeordnet werden.
Zur Bestimmung der Oxidationszahlen müssen also die Elektronegativitätswerte der Elemente herangezogen werden.
In Formeln werden die Oxidationszahlen in römischen Ziffern mit vorgesetztem "+" oder "-"-Zeichen über das betreffende Elementsymbol geschrieben oder im ausgeschriebenen Namen einer Verbindung als römische Zahl ausgedrückt.
Weitere Regeln, die in folgender Reihenfolge anzuwenden sind:
- Jedes Atom hat im elementaren Zustand die Oxidationszahl 0.
- Metall-Ionen (und B, Si) erhalten immer positive Oxidationszahlen, die der Ionenladung entsprechen.
- Fluor besitzt stets die Oxidationszahl -I (sofern sich nicht vorher eine andere Oxidationszahl ergibt).
- Wasserstoff erhält die Oxidationszahl +I (sofern sich nicht vorher eine andere Oxidationszahl ergibt).
- Sauerstoff erhält die Oxidationszahl -II (sofern sich nicht vorher eine andere Oxidationszahl ergibt).
- Halogene erhalten die Oxidationszahl -I (sofern sich nicht vorher eine andere Oxidationszahl ergibt).
Da die Oxidationszahlen die Bedeutung von Ladungszahlen besitzen, muss die Summe der Oxidationszahlen bei Molekülen gleich Null sein. Bei Ionen entspricht die Summe der Oxidationszahlen der Ionenladung.
Beispiele:
a)
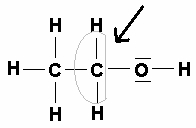 Beim Ethanolmolekül (links) soll die Oxidationszahl des Kohlenstoffatoms, welches nahe der Hydroxyl-Gruppe liegt, ermittelt werden: Das Kohlenstoffatom ist elektronegativer als das Wasserstoffatom. Also werden diese bindenden Elektronenpaare zum Kohlenstoffatom gezählt. Das Sauerstoffatom ist elektronegativer als das Kohlenstoffatom. Also wird dieses bindende Elektronenpaar dem Sauerstoffatom zugeschrieben. Zwischen den beiden Kohlenstoffatomen wird das bindende Elektronenpaar gleichmäßig aufgeteilt, da natürlich die Elektronegativitäten der beiden Kohlenstoffatome gleich sind.
Beim Ethanolmolekül (links) soll die Oxidationszahl des Kohlenstoffatoms, welches nahe der Hydroxyl-Gruppe liegt, ermittelt werden: Das Kohlenstoffatom ist elektronegativer als das Wasserstoffatom. Also werden diese bindenden Elektronenpaare zum Kohlenstoffatom gezählt. Das Sauerstoffatom ist elektronegativer als das Kohlenstoffatom. Also wird dieses bindende Elektronenpaar dem Sauerstoffatom zugeschrieben. Zwischen den beiden Kohlenstoffatomen wird das bindende Elektronenpaar gleichmäßig aufgeteilt, da natürlich die Elektronegativitäten der beiden Kohlenstoffatome gleich sind.
Kohlenstoff findet sich im PSE in der 4. Hauptgruppe. Alle Elemente der 4. Hauptgruppe besitzen vier Valenzelektronen. In unserem Beispiel besitzt das Kohlenstoffatom formal fünf Elektronen, also eines mehr. Da Elektronen negative Ladungen sind, besitzt das Kohlenstoffatom die Oxidationszahl –I.
b)

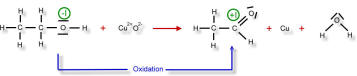
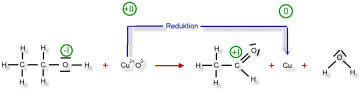
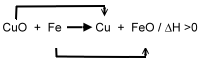
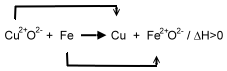




 Beim Ethanolmolekül (links) soll die Oxidationszahl des Kohlenstoffatoms, welches nahe der Hydroxyl-Gruppe liegt, ermittelt werden: Das Kohlenstoffatom ist elektronegativer als das Wasserstoffatom. Also werden diese bindenden Elektronenpaare zum Kohlenstoffatom gezählt. Das Sauerstoffatom ist elektronegativer als das Kohlenstoffatom. Also wird dieses bindende Elektronenpaar dem Sauerstoffatom zugeschrieben. Zwischen den beiden Kohlenstoffatomen wird das bindende Elektronenpaar gleichmäßig aufgeteilt, da natürlich die Elektronegativitäten der beiden Kohlenstoffatome gleich sind.
Beim Ethanolmolekül (links) soll die Oxidationszahl des Kohlenstoffatoms, welches nahe der Hydroxyl-Gruppe liegt, ermittelt werden: Das Kohlenstoffatom ist elektronegativer als das Wasserstoffatom. Also werden diese bindenden Elektronenpaare zum Kohlenstoffatom gezählt. Das Sauerstoffatom ist elektronegativer als das Kohlenstoffatom. Also wird dieses bindende Elektronenpaar dem Sauerstoffatom zugeschrieben. Zwischen den beiden Kohlenstoffatomen wird das bindende Elektronenpaar gleichmäßig aufgeteilt, da natürlich die Elektronegativitäten der beiden Kohlenstoffatome gleich sind.
