Bestimmung von Oxidationszahlen
Wenn organische Verbindungen chemische Reaktionen eingehen, ändert sich in der Regel die Oxidationszahl des Kohlenstoff-Atoms, das sich unmittelbar an der funktionellen Gruppe befindet oder selbst zur funktionellen Gruppe gehört.
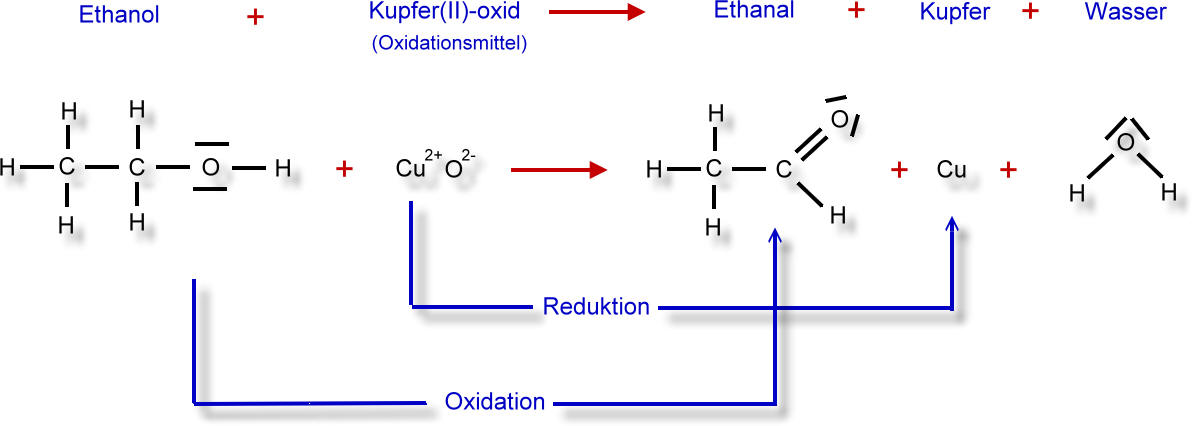
Im vorigen Artikel wurde die Oxidation von Ethanol zu Ethanal beschrieben.
Hier noch einmal das Reaktionsschema:
Schauen wir uns daher an, wie sich hier die Oxidationszahlen verändern.
Bedenke:
Bindungselektronen werden, wenn es sich um eine Einfachbindung handelt, mit einem Strich zwischen den an der Bindung beteiligten Atome gezeichnet. Ein Strich bedeutet zwei Elektronen.
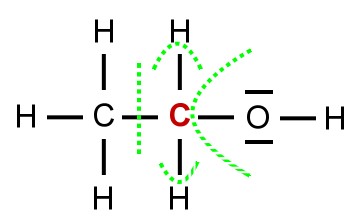
Zunächst werden die Bindungselektronen des Kohlenstoff-Atoms, das zur funktionellen Gruppe benachtbart ist (hier rot markiert), formal zugeordnet.
Regel 1:
Die Bindungselektronen gehören formal dem Atom, welches die höhere Elektronegativität besitzt.
Ein Sauerstoff-Atom hat eine höhere Elektronegativität als ein Kohlenstoff-Atom. Sauerstoff steht ja auch weiter rechts im PSE. Demzufolge ordnen wir die Bindungselektronen, die sich zwischen dem Sauerstoff-Atom und dem Kohlenstoff-Atom befinden formal dem Sauerstoff-Atom zu.
Ein Wasserstoff-Atom hat eine niedrigere Elektronegativität als ein Kohlenstoff-Atom. Wasserstoff steht ja auch ganz links im PSE. Demzufolge ordnen wir die Bindungselektronen zwischen dem Wasserstoff-Atom und dem Kohlenstoff-Atom dem Kohlenstoff-Atom zu.
Nun gibt es noch die vierte Bindung des Kohlenstoff-Atoms zu dem benachbarten Kohlenstoff-Atom. Hier gibt es keine Elektronegativitätsdifferenz, da beide Atome gleich stark an den Bindungselektronen ziehen. Demzufolge teilen sich die beiden Kohlenstoff-Atome die Bindungselektronen.
Wenn wir nun die formal dem Kohlenstoff-Atom zugeordneten Bindungselektronen addieren, dann kommen wir auf fünf Elektronen.
Regel 2:
Die formal zugeordnete Zahl an Elektronen wird mit der Elektronenzahl, die das Atom normalerweise auf der äußersten Schale hat (Valenzelektronen), verglichen. Die Anzahl an Valenzelektronen ist gleich der Hauptgruppenzahl im PSE. Die Differenz bildet die Oxidationszahl. Hat das Atom formal zu viele Eletronen, so ist die Oxidationszahl negativ, andernfalls positiv.
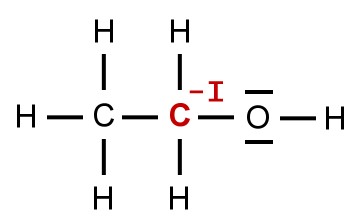
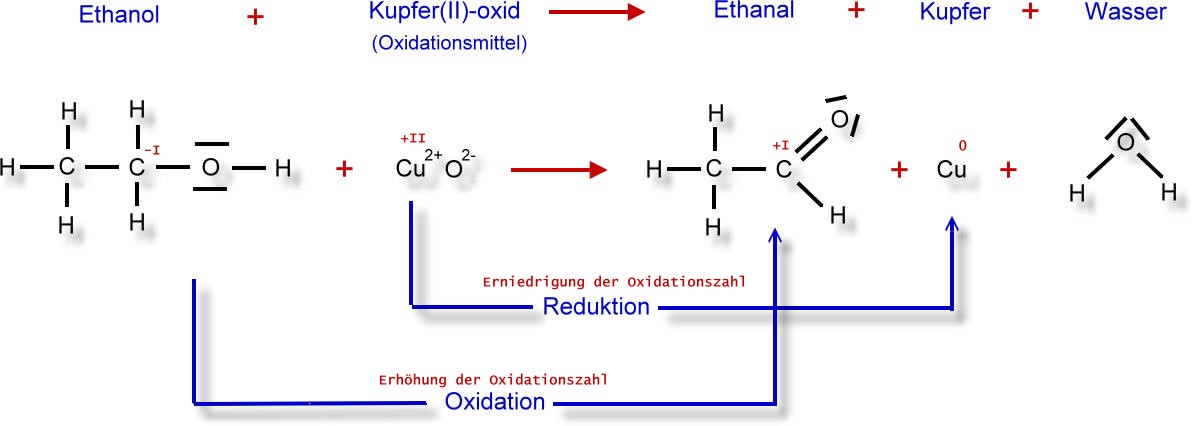
Im Fall des Ethanol-Moleküls hat also das betrachtete Kohlenstoff-Atom ein Elektron zu viel. Demzufolge ist die Oxidationszahl -I
Beim Ethanal befindet sich das zu betrachtende Kohlenstoff-Atom in der funktionellen Gruppe. Bei gleicher Vorgehensweise ergibt sich für Ethanal eine Oxidationszahl von +I.
 Die Reaktion von Ethanol zu Ethanal ist also eine Oxidation, da sich die Oxidationszahl erhöht hat (von -I auf +I).
Die Reaktion von Ethanol zu Ethanal ist also eine Oxidation, da sich die Oxidationszahl erhöht hat (von -I auf +I).
 Eine Erhöhung der Oxidationszahl bedeutet Oxidation, eine Erniedrigung bedeutet Reduktion.
Eine Erhöhung der Oxidationszahl bedeutet Oxidation, eine Erniedrigung bedeutet Reduktion.
Regel 3:
Bei Ionen entspricht die Ionenladung der Oxidationszahl. Kommt ein Stoff in einem Reaktionsschema als Element vor, so erhält es die Oxidationszahl 0.
Und hier nun das vollständige Reaktionsschema mit den Oxidationszahlen:
Es gibt noch eine andere Art Oxidationszahlen zu bestimmen. Diese kann man hier nach lesen.