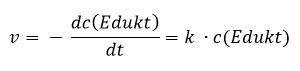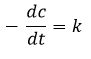Geschwindigkeitsgesetze
Die Reaktionsgeschwindigkeit ist proportional zur Konzentration der Ausgangsstoffe.
Betrachten wir einen einfachen Fall: Ein Edukt reagiert zu einem Produkt. In diesem Fall ist die Reaktionsgeschwindigkeit ausschließlich von der Konzentration c des Eduktes abhängig. Der proportionale Zusammenhang zwischen der Reaktionsgeschwindigkeit und der Konzentration des Eduktes nennt man Geschwindigkeitsgleichung oder auch Zeitgesetz:
k ist der Proportionalitätsfaktor (Geschwindigkeitskonstante).
Sind mehrere Edukte bei der Reaktion beteiligt, so gilt:
Die Summe der Exponenten stellt die sogenannte Reaktionsordnung dar.
 Die Geschwindigkeitskonstante k ist ein Maß für den Abbau bzw. Bildung der entsprechenden Stoffe. Je größer die Geschwindigkeitskonstante ist, desto schneller verläuft die Reaktion.
Die Geschwindigkeitskonstante k ist ein Maß für den Abbau bzw. Bildung der entsprechenden Stoffe. Je größer die Geschwindigkeitskonstante ist, desto schneller verläuft die Reaktion.
Die Reaktionsordnung lässt sich nur experimentell ermitteln. Sie ist aus einem Reaktionsschema nicht abzuleiten.
c/t-Diagramme
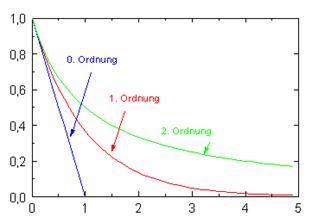
0. Ordnung
- Die Stoffmengenabnahme ist linear fallend.
- Die Reaktionsgeschwindigkeit ist unabhängig von der Konzentration konstant und nur von der Geschwindigkeitskonstante abhängig:
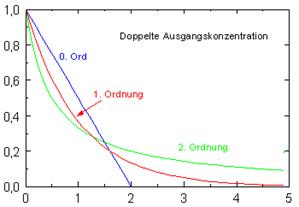
- Eine doppelte Menge verdoppelt auch die Reaktionszeit.
- Beispiele:
Geschwindigkeit der Aufnahme oder Ausscheidung eines Medikamentes, Ethanolabbau in der Leber, Ansteigen der Blutspiegelkurve bei intravenöser Tropfinfusion, Elektrolysen. Oft auch katalytische Prozesse wie z.B. die Zersetzung von Stickstoffmonooxid zu Stickstoff und Sauerstoff mittels Gold als Katalysator:
2 N2O (g)→ 2 N2 (g) + O2 (g)
1. Ordnung
- Die Stoffmengenabnahme ist anfangs groß, dann allmählich abnehmend (exponentielle Abklingkurve).
- Die Reaktionsgeschwindigkeit ist direkt proportional zur Konzentration eines Stoffes:
- Die Reaktionszeit ist unabhängig von der Ausgangskonzentration
- Die doppelte Menge hat keinen Einfluss auf die Reaktionszeit!
- Beispiel:
Zerfallsreaktion von Stickstoffpentoxid
2 N2O5 (g)→ 4 NO2 (g) + O2
2. Ordnung
- Die Stoffmengenabnahme ist anfangs groß, dann allmählich abnehmend - aber nicht exponentiell, sondern sie dauert mit Fortschreiten der Reaktionszeit immer länger.
- Die Reaktion ist entweder zum Quadrat der Konzentration eines Stoffes proportional oder prpportional zum Produkt der Konzentrationen zweier Stoffe.
- Die doppelte Menge führt zu einem dramatischen Anstieg der Anfangsreaktionsgeschwindigkeit. Es wird schneller eine niedrigere Konzentration erreicht.
- Beispiele:
H2 + I2→2 HI
2 NO2 (g) → N2O4
CHCl3(g) + Cl2(g)→ CCl4(g) + HCl (g)
Sonderfall:
Zur Untersuchung eines Stoffes wird die Reaktion oft mit einem Überschuss des anderen Stoffes durchgeführt, um das einfache Geschwindigkeitsgesetz 1. Ordnung zu erhalten. Man spricht dann von einer pseudo 1. Ordnung.