Unter welchen Bedingungen können Reaktionen starten?
Damit ein Stoff mit einem anderen Stoff reagieren kann, müssen beide Stoffe in Kontakt kommen. Oft müssen für eine chemische Reaktion Bindungen gespalten werden und neue Bindungen gebildet werden. Die Spaltung einer Bindung kann durch eine Temperaturerhöhung erfolgen: Zum einen schwingen die an einer Bindung beteiligten Teilchen immer heftiger, bis die Bindung gespalten wird. Zum anderen kann die Spaltung auch durch ein Zusammenstoß der Teilchen untereinander erfolgen, wenn die kinetische Energie der Teilchen entsprechend groß ist. Die Wahrscheinlichkeit des Zusammenstoßes erhöht sich mit zunehmender Konzentration und Temperatur, da die Geschwindigkeit der Teilchen auch zueinander zunimmt.
 Stoßtheorie (Kollisionstheorie): Damit eine chemische Reaktion zustande kommt, müssen die reagierenden Teilchen aufeinander treffen. Dazu brauchen sie eine Mindestenergie. Mit steigender Temperatur nimmt der Anteil wirksamer Zusammenstöße zu.
Stoßtheorie (Kollisionstheorie): Damit eine chemische Reaktion zustande kommt, müssen die reagierenden Teilchen aufeinander treffen. Dazu brauchen sie eine Mindestenergie. Mit steigender Temperatur nimmt der Anteil wirksamer Zusammenstöße zu.
Chemische Reaktionen laufen selten freiwillig ab, selbst wenn sie exotherm sind (siehe hierzu auch das Kapitel Energetik). Erst bei ausreichender kinetischer Energie der Teilchen kommt eine Reaktion in Gang. Diese Energie nennt man Aktivierungsenergie. Diese Startenergie bildet eine natürliche Barriere. Ansonsten würde das Zusammentreffen beliebiger Stoffe sofort in einem Inferno enden.
Wie man im Bild links sehen kann, ist ein sogenannter Katalysator in der Lage diese Barriere herabzusenken. Dies wird im Kapitel "Katalyse" näher erläutert.
Legende zum Bild links:
Die Beziehung zwischen Aktivierungsenergie (EA) und Bildungsenthalpie (ΔH) mit und ohne Katalysator am Beispiel einer exothermen Reaktion. Die energetisch höchste Position repräsentiert den Übergangszustand. Ein Katalysator verringert die zur Erreichung des Übergangszustands benötigte Energie.
 Unter Aktivierungsenergie versteht man die Energie zur Überwindung einer Reaktionshemmung. Sie kann durch einen Katalysator herabgesetzt werden.
Unter Aktivierungsenergie versteht man die Energie zur Überwindung einer Reaktionshemmung. Sie kann durch einen Katalysator herabgesetzt werden.
Stoffe, die für bestimmte Reaktionen eine hohe Aktivierungsenergie benötigen, sind reaktionsträge. Sie befinden sich in einem stabilen Energiezustand.
Stoffe, die eine geringe Aktivierungsenergie benötigen, sind reaktionsfreudige Stoffe, die ihren energetisch wenig stabilen Zustand verlassen wollen.
Geschwindigkeitsverteilung der Teilchen
Bei Raumtemperatur (20°C) bewegen sich Sauerstoffmoleküle mit einer durchschnittlichen Geschwindigkeit von 478 m/s [1]. Das ist beträchtlich, wenn man bedenkt, dass die Schallgeschwindigkeit 300 m/s beträgt. Wenn die Teilchen auf andere Teilchen stoßen, wird Energie ausgetauscht. Sie verändern dabei nicht nur ihre Geschwindigkeit, sondern auch ihre Bewegungsrichtung. So unterscheiden sich die Geschwindigkeiten der Teilchen selbst bei konstanter Temperatur beträchtlich, wie die folgende Maxwell-Boltzmann-Verteilung für Gase zeigt:
Die Fläche unterhalb der Kurven ist jeweils gleich groß (Gesamtzahl der Teilchen).
Im Diagramm ist die Mindestenergie (Emin) eingetragen, die zur Erreichung eines erfolgreichen Zusammenpralls von Teilchen (Aktivierungsenergie) und damit für das Zustandekommen einer Reaktion notwendig ist.
Man erkennt deutlich, dass bei hoher Temperatur wesentlich mehr Teilchen diese Bedingung erfüllen (gelbe Fläche unterhalb der jeweiligen Kurve).
In diesem Diagramm erreicht bei niedriger Temperatur kein Teilchen die Mindestenergie bzw. Mindestgeschwindigkeit.
 Der Prozentsatz an Teilchen mit hoher Geschwindigkeit erhöht sich bei Temperaturerhöhung dramatisch.
Der Prozentsatz an Teilchen mit hoher Geschwindigkeit erhöht sich bei Temperaturerhöhung dramatisch.
Sobald in einem Stoffgemisch erst einmal eine Bindung gespalten wurde und bei der Bildung einer neuen Bindung Energie freigesetzt wurde, kann diese frei gewordene Energie zur Spaltung einer weiteren Bindung genutzt werden. Mit anderen Worten: Die Reaktion ist gestartet und läuft nun freiwillig ohne weitere Zufuhr von Energie ab.
 Bei vielen Reaktionen verdoppelt sich die Reaktionsgeschwindigkeit bei einer Temperaturerhöhung um 10 K (RGT-Regel. Reaktionsgeschwindigkeits-Temperatur-Regel).
Bei vielen Reaktionen verdoppelt sich die Reaktionsgeschwindigkeit bei einer Temperaturerhöhung um 10 K (RGT-Regel. Reaktionsgeschwindigkeits-Temperatur-Regel).
Der Einfluss der Temperatur ist also außerordentlich wichtig. So kann die Haltbarkeit von Lebensmitteln bei der Kühlung auf die doppelte bis fünfzigfache Zeit verlängert werden.
---------------------------
[1] Werkstoffe für die Elektrotechnik: Mikrophysik, Struktur, Eigenschaften. Gerhard Fasching. 4. Auflage, 2005. S. 69.






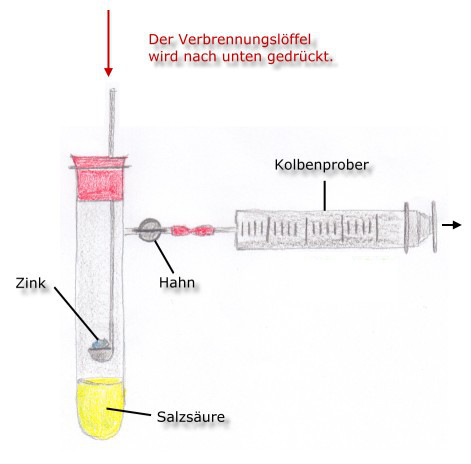 Betrachten wir die Reaktion von Zink mit Salzsäure. So könnte die Reaktionszeit für diese Reaktion vier Minuten betragen. Die Reaktionszeit ist abhängig von der Oberflächenbeschaffenheit des Zinks (Zerteilungsgrad), von der Konzentration, Menge und Temperatur der Salzsäure und von der Menge des eingesetzten Zinks ab.
Betrachten wir die Reaktion von Zink mit Salzsäure. So könnte die Reaktionszeit für diese Reaktion vier Minuten betragen. Die Reaktionszeit ist abhängig von der Oberflächenbeschaffenheit des Zinks (Zerteilungsgrad), von der Konzentration, Menge und Temperatur der Salzsäure und von der Menge des eingesetzten Zinks ab.
