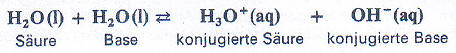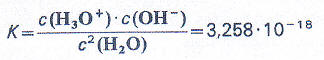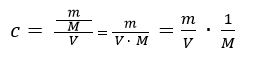Und destilliertes Wasser leitet den Strom doch!
Wasser, in dem ein Salz gelöst ist, eine Säure oder Lauge entahlten ist, leitet den elektrischen Strom, da die frei beweglichen Ionen dieser Stoffe elektrische Ladung, also Elektronen, transportieren können. Genaue Messungen zeigen jedoch, dass auch destilliertes Wasser, also reines Wasser ohne Fremd-Ionen, den elektrischen Strom leitet - wenn auch nur in einem extrem geringen Maße.
Das liegt an der sogenannten Autoprotolyse des Wassers. "Auto" bedeutet hier: Mit sich selbst. In reinem Wasser kann ein Wasser-Molekül ein Proton an ein andereres Wasser-Molekül abgeben. Dadurch entsteht ein Oxonium-Ion und ein Hydroxid-Ion. Anders ausgedrück: Es stellt sich ein Autoprotolyse-Gleichgewicht zwischen Wasser-Molekülen, Oxonium-Ionen und Hydroxid-Ionen ein:
Wobei die Konzentration der Oxonium-Ionen gleich der Konzentration der Hydroxid-Ionen ist.
Für Gleichgewichtsreaktionen kann man eine Gleichgewichtskonstante ermitteln bzw. nachschlagen und damit einen Hinweis bekommen, auf welcher Seite des Gleichgewichts die höheren Konzentrationen liegen. Die (temperaturabhängige) Gleichgewichtskonstante für die Autoprotolyse des Wassers beträgt:
Da der Wert extrem klein ist, kann man daraus schlussfolgern, dass das Gleichgewicht sehr stark auf der Eduktseite ist. Oder anders ausgedrückt: Es liegen bei diesem Gleichgewicht kaum Oxonium- bzw. Hydroxid-Ionen vor.
Wenn man nun aber die genaue Konzentration der Oxonium- bzw. Hydroxid-Ionen errechnen will, dann muss man die Gleichung wie folgt umformen:
c(H3O+) · c(OH-) = K · c2(H2O) ≈ 3,3 · 10-18 · c2(H2O)
Die Stoffmengenkonzentration des Wassers beträgt c = 55,4 mol/l.
Die Konzentrationsverminderung an Wassermolekülen durch die Bildung der Ionen ist so klein, dass man diesen Effekt bei der Berechnung vernachlässigen kann. Daher bezieht man die Konzentration des Wassers in die Gleichgewichtskonstante K mit ein und erhält eine neue Konstante Kw. Damit ergibt sich:
c(H3O+) · c(OH-) = 3,3 · 10-18 · (55,4 mol/l)2 = 10-14 · (mol/l)2 = Kw
Diesen Wert nennt man auch das Ionenprodukt des Wassers Kw.