Konjugierte Säure-Base-Paare nach Brönsted
Säuren bilden in wässriger Lösung Oxonium-Ionen:
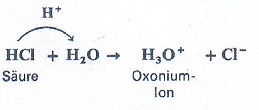
Basen bilden in wässriger Lösung Hydroxid-Ionen:
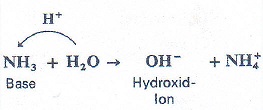
Die entsprechenden Reaktionen zwischen der Säure und dem Wasser bzw. zwischen der Base und dem Wasser sind Protolysereaktionen.

Protolysen sind immer reversible Reaktionen. Es stellt sich nach kurzer Zeit ein dynamisches Gleichgewicht ein. Aus einer Säure bildet sich ihre entsprechende Base. Diese wird dann konjugierte (coniugere, lat. = verbinden) oder auch korrespondierende (correspondere, lat. = übereinstimmen, sich entsprechen) Base genannt. Entsprechend bildet sich aus einer Base die entsprechende Säure:

Jedes Säure-Base-Gleichgewicht beinhaltet genau zwei Säure-Base-Paare.
Beispiele:

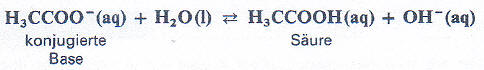
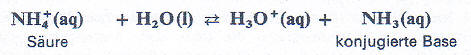
Sowohl neutrale Teilchen, als auch positive oder negative Ionen können Säure- oder Base-Funktion haben. So reagiert eine Ammoniumchlorid-Lösung sauer, eine Natriumacetat-Lösung hingegen alkalisch.



