Johannes Nicolaus Brønsted
1923 entwickelte Brønsted und (zeitgleich Lowry) eine Säuretheorie, die das Vorhandensein von Wasser nicht nötig machte (vergleiche hierzu die Säuretheorie von Arrhenius). Die Einzelheiten hierzu werden wir beleuchten, wenn wir das Thema Laugen und Basen behandeln.

Es ist also ein Wechselspiel zwischen zwei Stoffen, die durch eine Protonenwanderung (Protolyse, Protonenübertragungsreaktion) gekennzeichnet ist. Man spricht auch von einem korrespondierendem Säure-Base-Paar.
Teilchen, die Protonen abgeben können - also Säuren sind - werden Protonendonator genannt; Teilchen, die Protonen aufnehmen können, werden als Protonenakzeptoren (Basen) bezeichnet.
Wichtig: Moleküle, die nicht bindende, also freie Elektronenpaare besitzen, können in der Regel leicht protoniert werden.
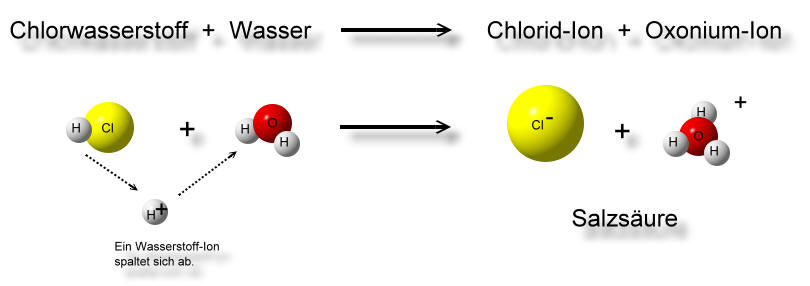
Oft ist die Base Wasser.
![]()
H3O+ -Ionen werden Oxonium-Ionen genannt. Alte Bezeichnungen sind: Hydroxonium-Ionen und Hydronium-Ionen. Nach den IUPAC-Regeln wird das protonierte Wassermolekül auch Oxidanium genannt. Diese Bezeichnung ist aber ungebräuchlich.
Die Oxonium-Ionen werden mit weiteren Wassermolekülen hydratisiert (H9O4+ = H3O+ · 3 H2O). Auch die hydratisierten Oxonium-Ionen werden Oxonium-Ionen genannt.