Farbverschiebungen
 Wenn man Tomatensaft, in dem der Farbstoff Lycopin enthalten ist, mit Brom reagieren lässt, dann werden Doppelbindungen - wie beim Versuch mit β-Carotin auf der vorigen Seite - durch die Addition von Brom-Atomen in Einfachbindungen umgewandelt. Das geschieht nicht mit einem mal, sondern allmählich.
Wenn man Tomatensaft, in dem der Farbstoff Lycopin enthalten ist, mit Brom reagieren lässt, dann werden Doppelbindungen - wie beim Versuch mit β-Carotin auf der vorigen Seite - durch die Addition von Brom-Atomen in Einfachbindungen umgewandelt. Das geschieht nicht mit einem mal, sondern allmählich.

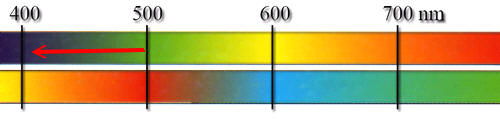
Demzufolge müsste eine Farbveränderung von rot über orange zu gelb zu erwarten sein, da ein kürzeres delokalisiertes π-Elektronensystem energiereichere, also kurzwelligere elektromagnetische Strahlung absorbiert. Einen solchen Effekt nennt man hypsochromen Effekt (Farbaufhellung):
(Oberer Balken: Absorbiertes Licht,
unterer Balken: Komplementärfarbe)
Tatsächlich beobachtet man neben der Gelbfärbung aber auch Farbveränderungen zu grün, lila und orange.
Woran liegt das? ...
Wenn anfangs nur einige Doppelbindungen durch die Bromierung verloren gegangen sind, haben die Brom-Atome mit ihren nicht bindenden, also einsamen Elektronenpaaren die Möglichkeit dem verbleibenden delokalisierten π-Elektronensystem Elektronen zur Verfügung zu stellen. Dadurch erweitert sich also das π-Elektronensystem in diesem Bereich wieder. Die Folge ist eine Absorption von länger welligerer Strahlung.
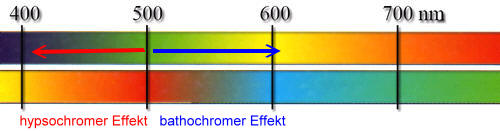
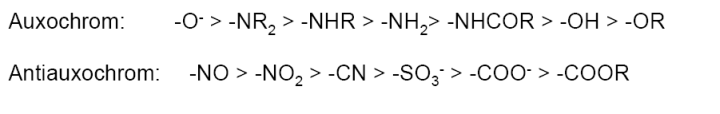
Solche Atome oder Atomgruppen, die freie Elektronenpaare abgeben können (Elektronendonatoren), werden auxochrome Gruppen genannt. Diese Wechselwirkung (+M-Effekt) mit dem delokalisierten π-Elektronensystem des Chromophors führt zu einer Verstärkung der Delokalisierung der π-Elektronen. Die Energiedifferenzen zwischen Grundzustand und angeregten Zuständen werden dann noch geringer, so dass langwelligeres Licht zur Anregung ausreicht und es zu einer Farbvertiefung kommt (bathochromer Effekt).
Bei geringem Bromierungsgrad überwiegt bei diesem Versuch der bathochrome Effekt. Bei höherem Bromierungsgrad sind kaum noch konjugierte Doppelbindungen vorhanden, es überwiegt die Farbaufhellung nach gelb. Es ergeben sich auch Zonen unterschiedlicher Färbung und Mischfarben (gelb + blau = grün).
Bei dem gleichen Versuch mit β-Carotin (siehe vorige Seite) lag die Absorption schon zu weit in der Nähe der UV-Strahlung, so dass sich der bathochrome Effekt der Brom-Atome nicht bemerkbar machte.
- Universität Bayreuth, Regenbogen im Tomatensaft, am 09.02.13 abgerufen
Zu den Antiauxochromen Gruppen zählt man funktionelle Gruppen mit elektronenziehender Wirkung
(–M-Effekt), die sich an dem mesomeren System des Chromophors beteiligen können und im Zusammenspiel mit einer auxochromen Gruppe den bathochromen Effekt verstärken. Man spricht in diesem Fall auch von einem push-pull-System.
Beispiele:
Das erste Beispiel zeigt einen Cyanin-Farbstoff der zur Klasse der Polymethin-Farbstoffe gehört. Die tertiäre Amino-Gruppe und die quartiäre Amonnium-Gruppe sind bei den Cyaninen über eine Polyen-Brücke verbunden. Beide Gruppen haben eine recht starke bathochrome Wirkung. Daher absorbieren Cyan-Farbstoffe trotz ihres sehr kleinen π-Elektronensystems bereits Licht im sichbaren Bereich.
Cyanin-Farbstoffe sind meistens blau und lichtempfindlich, weswegen sie in der Photographie Verwendung finden.
Ein anderes Beispiel:
Farbe des Stoffes: Orangerot