Typische Eigenschaften von Metallen sind:
- Gute elektrische Leitfähigkeit, die mit zunehmender Temperatur abnimmt.
- Gute Wärmeleitfähigkeit.
- Plastische Verformbarkeit.
- Metallischer Glanz.
1. Elektrische Leitfähigkeit
Strom ist die Bewegung von Elektronen. Wird an einem Metall eine Spannung angelegt (Elektronenüberschuss auf der einen Seite, Elektronenmangel auf der anderen Seite), gibt das Metall auf der einen Seite Elektronen ab und nimmt auf der anderen Seite Elektronen auf. Aus einer ungeordneten Bewegung der Elektronen wird eine eher gerichtete Bewegung.
Die höchste Leitfähigkeit unter den Metallen zeigt Silber, gefolgt von Kupfer, Gold und Aluminium. Die elektrische Leitfähigkeit nimmt bei den Metallen mit steigender Temperatur ab. Das liegt daran, dass bei niedriger Temperatur die Atome nur wenig schwingen, sodass die Bewegung der Elektronen kaum eingeschränkt wird. Bei hohen Temperaturen schwingen die Atome stärker und behindern dadurch den Elektronenfluss. Der elektrische Widerstand nimmt zu.
2. Wärmeleitfähigkeit
Temperatur beschreibt die Geschwindigkeit, mit der sich Teilchen ungeordnet bewegen (bei Gasen) bzw. "zittern" (bei Feststoffen). Wenn sich solche bewegenden Teilchen in Kontakt mit einem Metall befinden, wird die Bewegungsenergie auf die Elektronen des Metalls übertragen: Die Elektronen im Metall bewegen sich schneller, die Teilchen, die mit dem Metall in Berührung gekommen sind, bewegen sich langsamer bzw. "zittern" nicht mehr so stark. Auf diese Weise wird Wärme übertragen. Das erklärt, warum sich Metalle bei Raumtemperatur kalt anfühlen und warum man in der Sauna keine Metallgegenstände anfassen sollte.
 Was ist der Unterschied zwischen Temperatur und Wärme?
Was ist der Unterschied zwischen Temperatur und Wärme?
Während die Temperatur den Zustand der Teilchengeschwindigkeit beschreibt, bei dem sich die Teilchen chaotisch in alle Richtungen bewegen, ist Wärme der Vorgang des Energieaustauschs zwischen Stoffen mit unterschiedlicher Temperatur.
3. Plastische Verformbarkeit
Metalle lassen sich unter Druck verformen, sie brechen nicht leicht und sind daher nicht spröde. Das liegt daran, dass sich die Atome im Atomverband beim Biegen gut verschieben lassen. Die Elektronen wirken gewissermaßen als "Schmiermittel". Mischt man ein Metall mit einem anderen Metall, indem man die Metalle zusammenschmilzt, ist die Verschiebbarkeit durch die unterschiedliche Größe der Atome eingeschränkt: Metalllegierungen sind oft härter und spröder als die reinen Metalle.
4.Metallischer Glanz
Wiederholung
Bei den Salzen haben wir die Flammenprobe durchgeführt und gelernt, dass die Metall-Ionen durch die zugefügte Brennerenergie aus dem Ionen-Verband herausgerissen werden. Im Gasraum bilden sich aus den Ionen auch Metall-Atome. Durch die Energie der Brennerflamme springen die Valenzelektronen auf eine höhere Schale, und beim Zurückspringen geben sie die aufgenommene Energie in Form von Licht wieder ab. Da die Abstände der Schalen für jedes Metall typisch sind, sind auch die Flammenfärbungen für die Metalle typisch.
Trifft Licht auf eine Metalloberfläche, werden die sich frei bewegenden Elektronen ("Elektronengas") zum Schwingen angeregt. Die schwingenden Elektronen senden nun wieder Energie in Form von Licht aus. Dieses ausgesendete Licht lässt die Metalle glänzen.
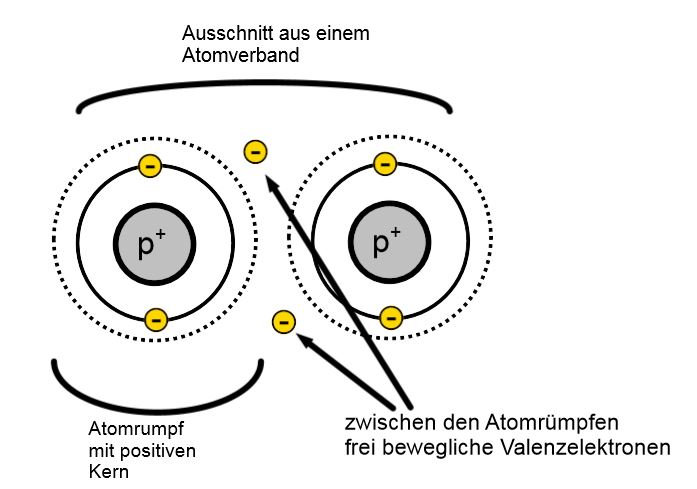
 Die gemeinsame Benutzung von sich schnell bewegenden Valenzelektronen zwischen den Atomrümpfen des Atomverbandes nennt man Metallbindung.
Die gemeinsame Benutzung von sich schnell bewegenden Valenzelektronen zwischen den Atomrümpfen des Atomverbandes nennt man Metallbindung.