Das Prinzip
am .
- Bild 1
- Bild 2
- Bild 3
- Bild 4
- Bild 5
- Bild 6
- Bild 7
- Bild 8
- Bild 9
- Bild 10
 Metalle bestehen aus Metall-Atomen. Die Valenzelektronen der Metalle können sich zwischen den Atomrümpfen frei bewegen ("Elektronengas"). Siehe auch Metallbindung.
Metalle bestehen aus Metall-Atomen. Die Valenzelektronen der Metalle können sich zwischen den Atomrümpfen frei bewegen ("Elektronengas"). Siehe auch Metallbindung. Nach außen hin ist ein Metall zunächst einmal elektrisch neutral, da es genauso viele Elektronen wie Protonen (im Kern der Atome) besitzt.
Nach außen hin ist ein Metall zunächst einmal elektrisch neutral, da es genauso viele Elektronen wie Protonen (im Kern der Atome) besitzt.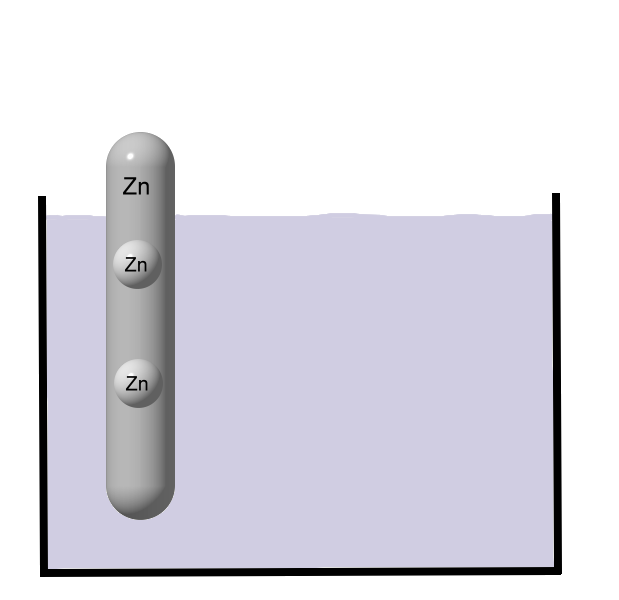 Wenn ein Metall mit Wasser in Berührung kommt, dann löst sich das Metall langsam auf.
Wenn ein Metall mit Wasser in Berührung kommt, dann löst sich das Metall langsam auf.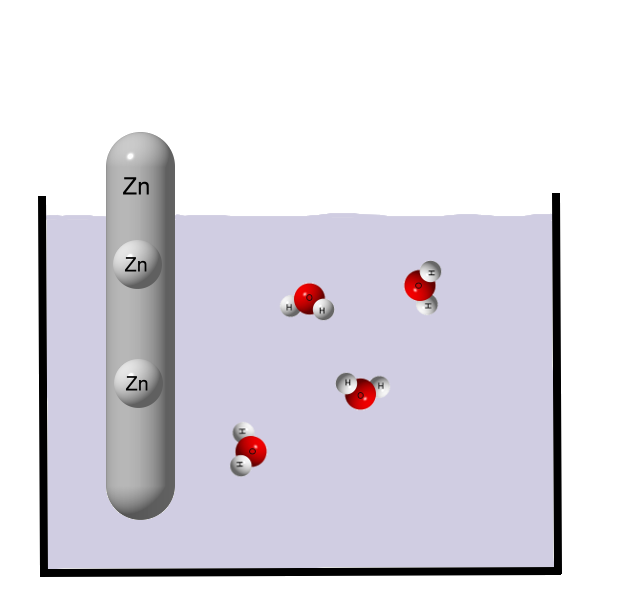 Wasser besteht aus polaren Wassermolekülen. Wassermoleküle sind Dipolmoleküle, die Atome eines Wassermoleküls besitzen Partialladungen.
Wasser besteht aus polaren Wassermolekülen. Wassermoleküle sind Dipolmoleküle, die Atome eines Wassermoleküls besitzen Partialladungen.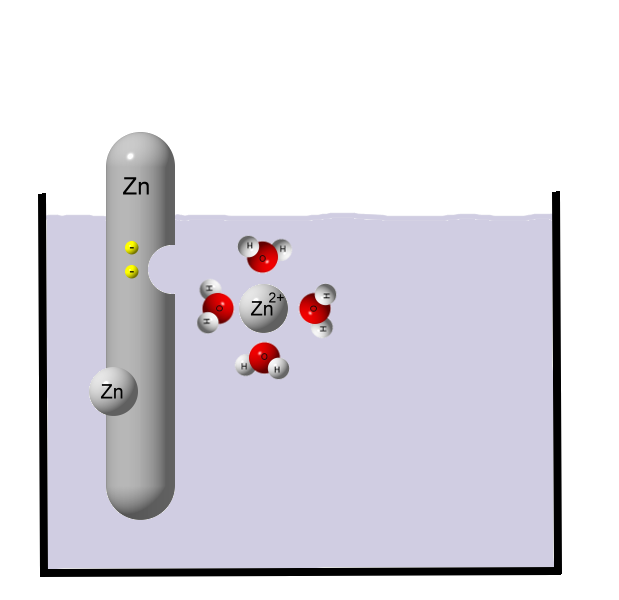 Zink ist ein unedles Metall und gibt daher gerne Elektronen ab. Es entstehen Zink-Ionen:
Zink ist ein unedles Metall und gibt daher gerne Elektronen ab. Es entstehen Zink-Ionen:
Zn → Zn2+ + 2e-
Zink oxidiert (Abgabe von Elektronen). Die Elektronen verbleiben beim Metall, die Zink-Ionen wandern ins Wasser und werden dort von Wassermolekülen umhüllt (Hydrathülle). Während Zink-Atome in Wasser unlöslich sind, können sich Zink-Ionen sehr gut in Wasser lösen.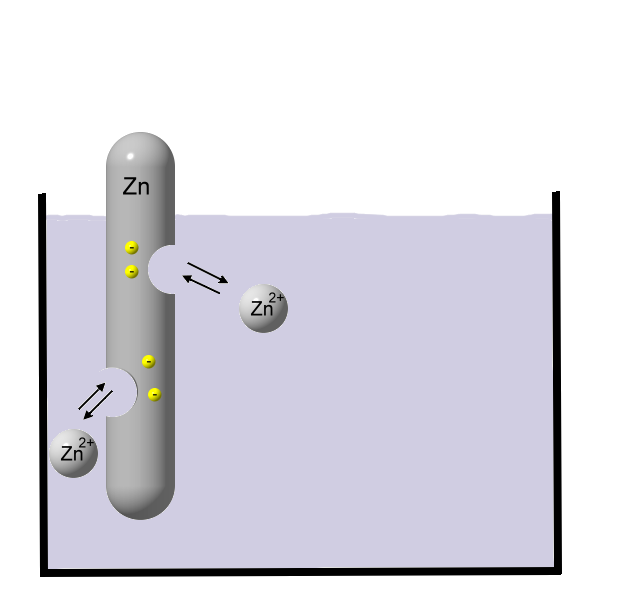 Je mehr Zink sich auflöst, also Zink-Ionen in Lösung gehen, desto größer ist der Elektronenüberschuss beim Metall. Irgendwann stellt sich ein chemisches Gleichgewicht ein, da die positiv geladenen Zink-Ionen vom Elektronenüberschuss angezogen werden.
Je mehr Zink sich auflöst, also Zink-Ionen in Lösung gehen, desto größer ist der Elektronenüberschuss beim Metall. Irgendwann stellt sich ein chemisches Gleichgewicht ein, da die positiv geladenen Zink-Ionen vom Elektronenüberschuss angezogen werden.
Die Hydrathüllen sind der Übersicht halber hier weggelassen.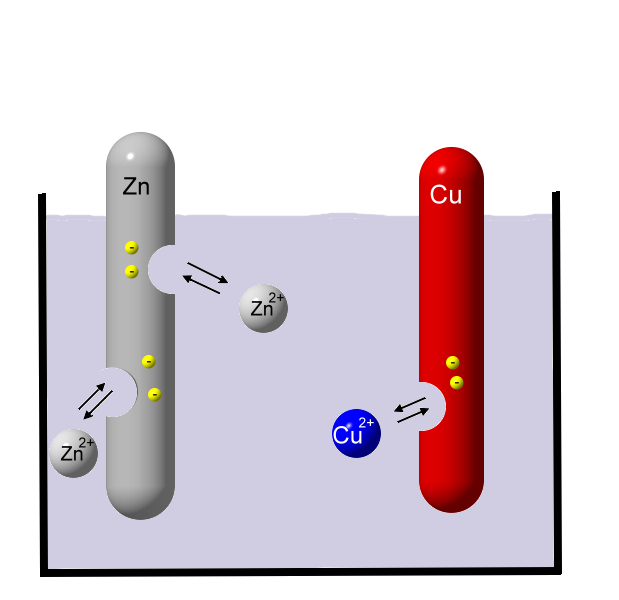 Kupfer ist viel edler als Zink, es gibt sehr ungerne Elektronen ab. Daher gehen viel weniger Kupfer-Ionen in Lösung. Kupfer löst sich also nicht so gut in Wasser wie Zink. An der Zinkstange entsteht also eine stärkere negative Ladung als an der Kupferstange. Zwischen den beiden Metallen herrscht ein Ladungsunterschied (elektrische Spannung).
Kupfer ist viel edler als Zink, es gibt sehr ungerne Elektronen ab. Daher gehen viel weniger Kupfer-Ionen in Lösung. Kupfer löst sich also nicht so gut in Wasser wie Zink. An der Zinkstange entsteht also eine stärkere negative Ladung als an der Kupferstange. Zwischen den beiden Metallen herrscht ein Ladungsunterschied (elektrische Spannung).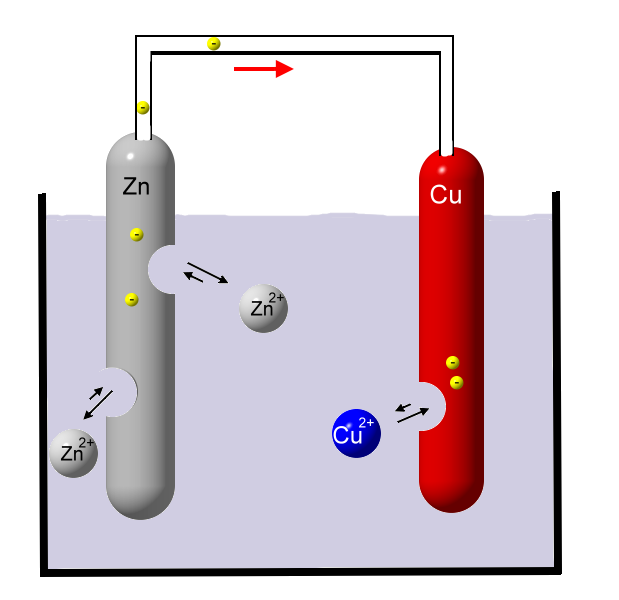 Verbindet man beide Metalle über einen leitfähigen Draht, so bewegen sich die Elektronen vom Zink über diesen Draht zum Kupfer, um den Ladungsunterschied auszugleichen: Es fließt Strom! Die wenigen Kupfer-Ionen nehmen dort Elektronen auf und werden somit wieder zum elementaren Kupfer.
Verbindet man beide Metalle über einen leitfähigen Draht, so bewegen sich die Elektronen vom Zink über diesen Draht zum Kupfer, um den Ladungsunterschied auszugleichen: Es fließt Strom! Die wenigen Kupfer-Ionen nehmen dort Elektronen auf und werden somit wieder zum elementaren Kupfer.
Es gelangen aber auch Kupfer-Ionen zum Zinkstab, wo sie Elektronen aufnehmen und zu Kupfer-Atomen reduziert werden. Es scheidet sich Kupfer am Zinkstab ab. Das führt zum Blockieren der Zink-Ionen-Bildung. Man sagt, der Zinkstab wird vergiftet. Mit fortlaufender Versuchsdauer erhöht sich die Konzentration an Zink-Ionen, die ebenfalls die Kupferelektrode vergiften können.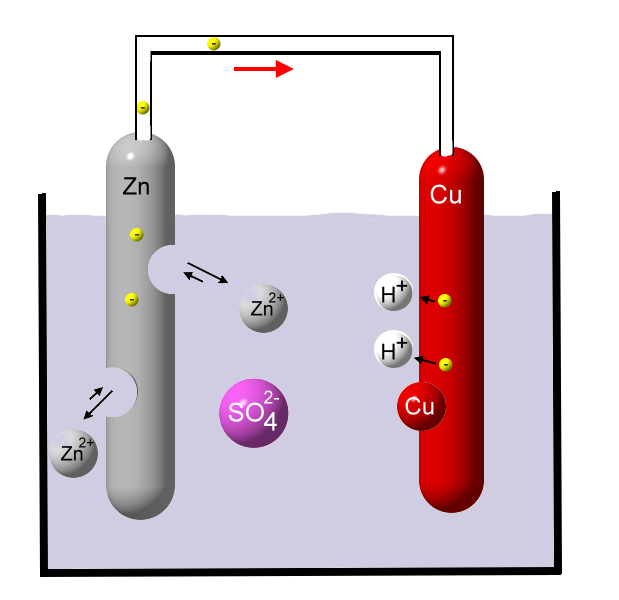 Eine Zugabe von Schwefelsäure (H2SO4) führt zu einer erhöhten Abgabe an Elektronen vom Kupferstab. Dadurch erhöht sich die Ladungsspannung.
Eine Zugabe von Schwefelsäure (H2SO4) führt zu einer erhöhten Abgabe an Elektronen vom Kupferstab. Dadurch erhöht sich die Ladungsspannung.
Ein weiterer Vorteil ist die Reaktion von Schwefelsäure mit dem unedlen Metall Zink. Dadurch wird die Kupfer-Elektrode weniger durch Zink vergiftet.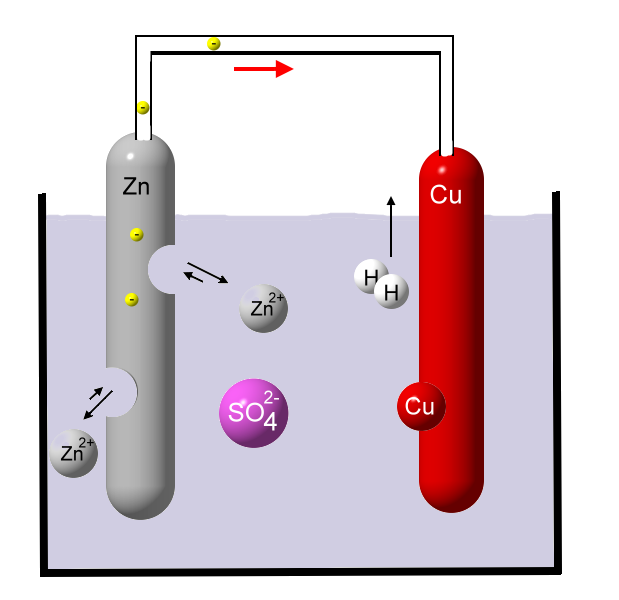 Je zwei gebildete Wasserstoff-Atome bilden ein Wasserstoff-Molekül. Auf diese Art und Weise werden immer wieder Elektronen von dem Kupferstab entfernt und das System ist verstärkt bemüht den Ladungsunterschied auszugleichen.
Je zwei gebildete Wasserstoff-Atome bilden ein Wasserstoff-Molekül. Auf diese Art und Weise werden immer wieder Elektronen von dem Kupferstab entfernt und das System ist verstärkt bemüht den Ladungsunterschied auszugleichen.
Zinkelektrode:
Zn(s) → Zn2+(aq) + 2e- [Oxidation]
Kupferelektrode:
Cu2+(aq) + 2e- → Cu(s) [Reduktion]
--------------------------------------
Gesamtreaktion:
Cu2+(aq) + Zn(s) → Zn2+(aq) + Cu(s) [Redoxreaktion]
Kommentar schreiben





