Arrhenius - diesmal anders
Nach Arrhenius sind Säuren Stoffe, die mit Hilfe von Wasser zu Wasserstoff-Ionen und einem Säurerest dissoziieren.
Genaugenommen erscheint hier die Säure-Base-Theorie von Arrhenius ein wenig holprig: Während die Bildung von Säuren ein chemischer Prozess ist (heterolytische Spaltung von polaren Atombindungen), bei dem tatsächlich neue Stoffe entstehen, ist die Bildung von Laugen ein physikalischer Lösevorgang, da ja die Hydroxid-Ionen schon vorher in einem Ionengitter vorhanden sind.
Beispiel:
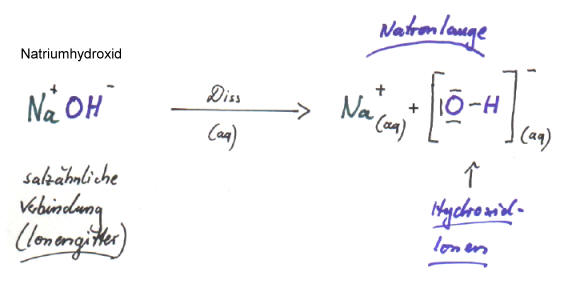
Bei den Verhältnisformeln von Metallhydroxiden in Ionenformelschreibweise muss man sich vergegenwärtigen, dass die Hydroxid-Ionen eine Einheit bilden. Eindeutiger wäre demnach folgende Schreibweise: Na+(OH)-. Bei Metallhydroxiden, die zweifach positiv geladene Metall-Ionen enthalten, wird die Formelschreibweise allerdings eindeutiger, z.B. bei Mg2+(OH-)2.
Es sei an dieser Stelle schon mal erwähnt, dass die Dissoziation - als Lösevorgang betrachtet - nicht die einzige "Schwachstelle" in der Basetheorie von Arrhenius ist. Zum Beispiel bildet Ammoniak (NH3) in Wasser eine alkalische Lösung, die den Universalindikator blau färbt. Ammoniak besitzt jedoch, wie man an der Summenformel erkennen kann, keine Hydroxid-Ionen. Eine andere "Schwachstelle" ist darin zu sehen, dass die Arrhenius-Theorie nur für wässrige Lösungen gilt. Es gibt jedoch auch Säure-Base-Reaktionen, die ohne Wasser ablaufen. Die Brönsted-Theorie liefert hier wesentlich bessere Erklärungsmuster.



