Reaktionsmechanismus der radikalischen Substitution an Alkanen
 Ein Reaktionsmechanismus zeigt in Strukturformelschreibweise, wie sich die an der Reaktion beteiligten Teilchen während des Reaktionsverlaufes verändern. Dazu wird die Reaktion in Teilschritten gegliedert.
Ein Reaktionsmechanismus zeigt in Strukturformelschreibweise, wie sich die an der Reaktion beteiligten Teilchen während des Reaktionsverlaufes verändern. Dazu wird die Reaktion in Teilschritten gegliedert.
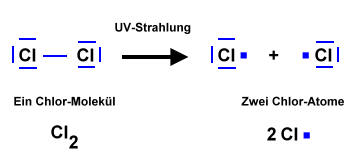
Während Brom-Moleküle schon durch Licht aus dem für uns Menschen sichtbaren Lichtspektrum in Brom-Atome gespalten werden können, erfolgt die Spaltung von Chlor-Molekülen nur durch energiereichere UV-Strahlung. Dabei entstehen Radikale, die letztendlich zu einem Austausch (Substitution = Austausch) von Wasserstoff-Atomen des Alkans mit Chlor-Atomen führt.
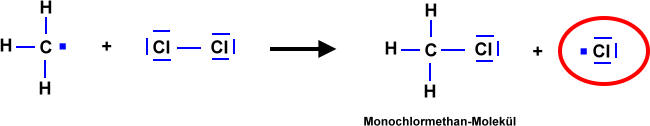
Beispiel: Reaktion von Methan mit Chlor
Startreaktion
Atome, die ungepaarte Valenzelektronen besitzen, werden Radikale genannt. Dies sind immer äußerst reaktive Teilchen.
Der Punkt in der Valenzstrichformel (Lewisformel) steht für das ungepaarte Elektron des Radikals.
Kettenreaktion
Chlor-Radikale entreißen Methan-Molekülen Wasserstoff-Atome. Es entstehen Methyl-Radikale und Chlorwasserstoff-Moleküle. Die "Radikaleigenschaft" wird gewissermaßen auf ein anderes Teilchen übertragen.
Chlorwasserstoff ist ein Gas (g), das mit Wasser die Salzsäure bildet. Siehe auch hier.
Das Entscheidende ist, dass sich im Folgenden wieder Chlorradikale bilden, die dann, nach dem obigen Reaktionsschema, mit weiteren Methan-Molekülen reagieren:
Chlor-Radikale wirken hier demnach als Katalysator.
Auf diese Weise können auch mehrfach halogenierte Kohlenwasserstoffe gebildet werden. Bei der Reaktion von Chlor mit Methan z.B. Dichlormethen, Trichlormethan oder Tetrachlormethan.
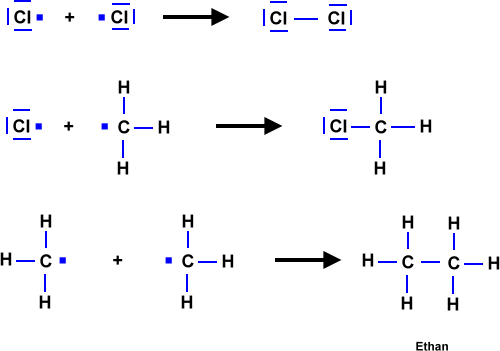
Abbruchreaktionen
Stoßen zwei Radikale zusammen, so können die beiden ungepaarten Elektronen eine Elektronenpaarbindung bilden. Es entsteht ein Molekül, das nicht mehr weiter reagiert. Verschiedene Kombinationen sind für eine Abbruchreaktion möglich: