Synthese von Halogenalkanen
Gibt man zu einem Alkan, wie z.B. iso-Octan etwas Brom, so entsteht aus beiden Stoffen ein homogenes Gemisch, ohne dass hierbei ein Anzeichen von einer Reaktion zu beobachten ist. Wird jedoch das Gemisch beleuchtet (z.B. mit Hilfe eines Overheadprojektors), so kann man folgende deutbare Beobachtungen machen:
- Das Gemisch entfärbt sich => Das braune Brom wird verbraucht. Es muss eine Reaktion stattgefunden haben. Das Reaktionsprodukt ist farblos. Es ist ein Halogenalkan entstanden.
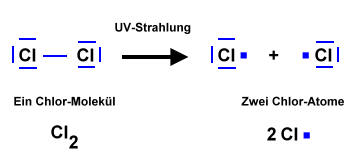
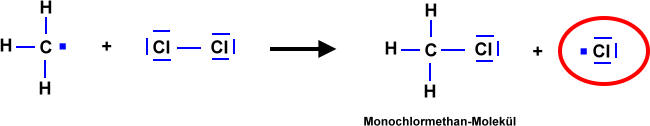
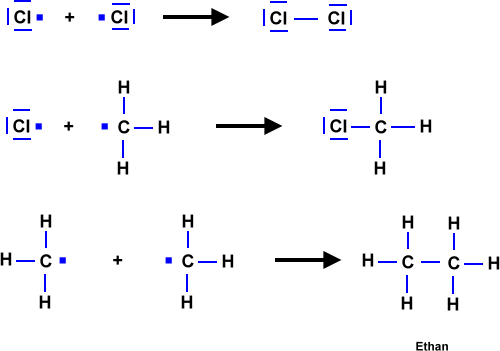
- Licht löst die Reaktion aus => Damit zwei Stoffe miteinander reagieren können, müssen zunächst Bindungen "gebrochen" werden. Anschließend "ordnen" sich die Atome zu einem neuen Stoff. Durch Licht werden Brom-Moleküle in Brom-Atome gespalten. Die Brom-Atome reagieren dann mit dem Alkan zum Halogenalkan.
- Ein mit Wasser angefeuchteter Streifen Universalindikator-Papier färbt sich rot => Es entsteht ein zweites Raktionsprodukt, das mit Wasser eine Säure bildet. Es ist Bromwasserstoff(gas) entstanden, das mit Wasser Bromwasserstoffsäure bildet.
- Es bildet sich über der Flüssigkeit ein weißer Nebel => Die Bildung von Bromwasserstoffsäure aus Bromwasserstoff(gas) geschieht schon mit Hilfe der Luftfeuchtigkeit.



 Ein
Ein