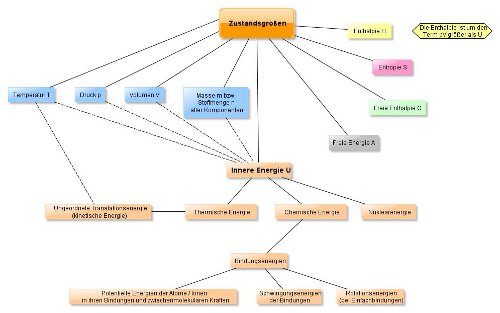
Innere Energie
Jeder Stoff besitzt eine Innere Energie (Symbol: U). Diese setzt sich aus verschiedenen Arten von Energien zusammen:
- Kernenergie (Nuklearenergie), die jedoch nicht Gegenstand der Chemie ist.
- Thermische Energie, die durch die Bewegung von Teilchen zustande kommt wie z.B. bei Gasen (ungeordnete, kinetische Translationsenergie). Oder z.B. durch die Bewegung der Wassermoleküle im flüssigen Wasser. Die thermische Energie ist übrigens auch im Hinblick auf einen Reaktionsablauf von entscheidender Bedeutung (z.B. die Wucht, mit der die Teilchen bei einer chemischen Reaktion aufeinander prallen. Dies wird allerdings erst im 4. Halbjahr beim Thema Kinetik ausführlich behandelt.
- Chemische Energie (Bindungsenergien)
- Potentielle Energien der Atome bzw. Atomkerne, der Ionen in ihren Bindungen und der zwischenmolekularen Kräfte.
- Schwingungsenergien der Bindungen.
- Rotationsenergien (bei Einfachbindungen)
Also:
U = Ekern + Etherm + Echem
Die Innere Energie ist von verschiedenen Zustandsgrößen abhängig:
Druck (p), Volumen (V), Masse (m) bzw. Stoffmenge (n) , Temperatur (T).
Es gibt keinen Absolutwert für die Innere Energie.
Man kann lediglich Änderungen der inneren Energie messen: ΔU.
Änderung der Inneren Energie bei Stoffumwandlungen
Bei einer Stoffumwandlung, also einer chemischen Reaktion, werden nicht nur neue Soffe mit anderen Eigenschaften gebildet, es ändert sich auch die Innere Energie der Stoffe. Das Edukt hat eine andere Innere Energie als das Produkt. [Das gleiche gilt natürlich auch bei einer chemischen Reaktion, die mehrere Edukte und Produkte aufweisen.]
Die Änderung der inneren Energie eines stofflichen Systems bei Stoffumwandlungsprozessen wird als Reaktionsenergie bezeichnet:
ΔrU
Prinzipiell gibt es zwei unterschiedliche Voraussetzungen, unter denen chemische Reaktionen ablaufen:
- Bei Reaktionen unter isochoren Bedingungen, also bei konstantem Volumen (V) wird die Änderung der Inneren Energie als Reaktionswärme QV bezeichnet.
ΔrU = QV
Beispiele:
- Reaktionen in einem Druckbehälter, in dem Gase an der Reaktion beteiligt sind. So kann ein bei einer Reaktion entstehendes Gas in einem Druckbehälter keine Volumenänderung herbeiführen.
- Reaktionen von Feststoffen, die zu keiner Volumenänderung führen.
- Lösevorgänge. So ist die Volumenänderung beim Lösen eines Salzes so gering, dass sie vernachlässigt werden kann.
- Bei Reaktionen unter isobaren Bedingungen, also bei konstantem Druck (p), muss die Volumenarbeit berücksichtigt werden, die ein entstehendes Gas verrichten kann.
ΔrU = Qp - p ⋅ ΔV
Die Zustandgrößen U, p und V werden zu einer neuen Zustandsgröße zusammengefasst: der Enthalpie H.
Qp = H = U + p ⋅ V
In solchen Fällen sollte man bei der Reaktionsenergie nicht von Reaktionswärme sprechen, sondern eben von der Enthalpie.
Beispiele:
-
- Alle Reaktionen in offenen Systemen (z.B. offenes Reagenzglas). Die Druckänderung in unserer Atmosphäre durch das Entstehen eines Gases bei einer Reaktion in einem Reagenzglas kann vernachlässigt werden ;)
- Reaktionen in geschlossenen Systemen, bei denen der Druck konstant gehalten wird (siehe auch nächste Seite).