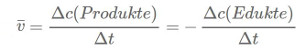Mittlere Reaktionsgeschwindigkeit
Reaktionsgeschwindigkeit für eine bestimmte Zeitspanne

Die mittlere Reaktionsgeschwindigkeit ist der Quotient aus der Konzentrationsänderung Δc und der dafür benötigten Zeitspanne Δt. Entsprechend kann man die Reaktionsgeschwindigkeit auch als die Abnahme der Konzentration eines Ausgangsstoffes beziehen. Da Reaktionsgeschwindigkeiten keinen negativen Wert haben können, setzt man vor dem Quotienten vereinbarungsgemäß ein Minuszeichen.
Einheit: mol · l-1 · min
Dabei ist es gleichgültig, welche der an der Reaktion beteiligten Stoffe man betrachtet, da alle Stoffe über die stöchiometrische Gleichung miteinander verbunden sind.
Folgende Reaktion, bei der die Konzentrationsabnahme von Wasserstoff-Ionen (pH-Wert-Messung, Messung der elektrischen Leitfähigkeit) bzw. die Wasserstoffentwicklung gemessen werden kann, soll das verdeutlichen:
Nehmen wir noch einmal das Beispiel "Reaktion von Zink mit Salzsäure" vom Beitrag Reaktionszeit.
2 HCl + Zn → H2 + ZnCl2 /ΔH < 0 [Summenformelschreibweise]
2 H+ + 2 Cl- + Zn → H2 + Zn2+ + 2 Cl- /ΔH < 0 [Ionenformelschreibweise]
Bei dieser Reaktion nimmt auf der Eduktseite die Konzentration an Wasserstoff-Ionen ab, auf der Produktseite nimmt die Konzentration an Zink-Ionen zu. Die entscheidenden Teilchen, die wir für den Verlauf der Reaktion betrachten sind also:
2 H+ + Zn → H2 + Zn2+ (Zn im Überschuss = konst.)
Für die Bildung von einem Mol Zink(II)-Ionen werden zwei Mol Wasserstoff-Ionen verbraucht. Die Konzentration an Wasserstoff-Ionen nimmt also doppelt so schnell ab, wie die Konzentration an Zink(II)-Ionen zunimmt:
Die Abhängigkeit einer Größe von einer anderen Größe kann man durch eine Funktion f(x) ausdrücken. Jeder Eingangsgröße (Argument, meist x) ist eine Ausgangsgröße (Funktionswert, meist y) zugeordnet. Eine Funktion kann graphisch dargestellt werden.
Konzentrations/Zeit-Diagramme (c/t-Diagramm)
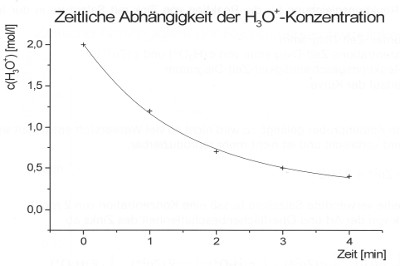
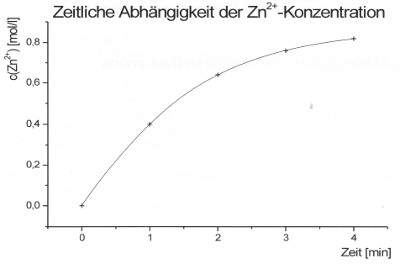
Hier ist die Konzentrationsabnahme von Wasserstoff-Ionen (Protonen) bzw. Oxonium-Ionen dargestellt. Der Funktionsgraph zeigt eine exponentielle Abklingfunktion. Für die Zunahme der Zink(II)-Ionenkonzentration ergibt sich eine spiegelbildliche Sättigungskurve.
Eine chemische Reaktion, wie die Reaktion einer Säure mit einem unedlen Metall verläuft also zu Beginn am schnellsten.
 Der Differenzenquotient ist graphisch betrachtet die Steigung der Sekante. Die Steigung der Sekante gibt die mittlere Reaktionszeit an.
Der Differenzenquotient ist graphisch betrachtet die Steigung der Sekante. Die Steigung der Sekante gibt die mittlere Reaktionszeit an.
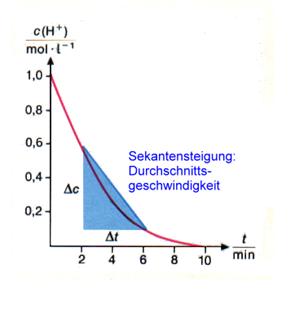
Die Steigung der Sekante, also die Reaktionsgeschwindigkeit in diesem Zeitabschnitt, ist zu Beginn der Reaktion am größten. Ist ja auch klar: Gibt man Zink in Salzsäure, so ist die Gasentwicklung zu Beginn am größten - dann nimmt sie zunehmend ab.
Die Reaktionsgeschwindigkeit ist in der Regel von den Konzentrationen der Reaktionsteilnehmer abhängig. Da sich die Konzentrationen während der hier betrachteten Reaktion mit zunehmender Reaktionszeit immer langsamer verändern, ändert sich auch die Reaktionsgeschwindigkeit entsprechend. Da die Konzentration der Ausgangsstoffe abnimmt, nimmt hier auch die Reaktionsgeschwindigkeit ab.