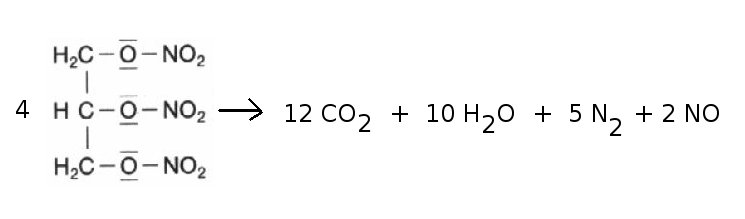Anorganische Ester
Nitroglycerin, ein Salpetersäuretriester
Gleichwohl es in diesem Kapitel um organische Ester geht, soll nicht verschwiegen werden, dass es auch sogenannte anorganische Ester gibt.
Eines der bekanntesten ist Nitroglycerin (besser: Glycerintrinitrat). So erstaunlich das auch scheinen mag: Organische Ester des Glycerins sind für uns lebensnotwendig (siehe Fette), verestert man Glycerin mit einem Gemisch aus Salpetersäure und Schwefelsäure (Nitriersäure), so erhält man einen Sprengstoff:
Nitroglycerin zerfällt bei der Explosion zu Kohlenstoffdioxid, Wasserdampf, Stickstoff und Stickstoffmonooxid. Aus vier mol Nitroglycerin entstehen 29 mol Gase, die sich mit Überschallgeschwindigkeit ausbreiten (Druckwelle, Durchbrechen der Schallmauer: Knall).
 Nitroglycerin wurde erstmals 1847 von dem italienischen Arzt und Chemiker ASCANIO SOBRERO hergestellt [1]. ALFRED NOBEL (Bild links) ist es zu verdanken, dass er diese Flüssigkeit, die schon bei geringsten Erschütterungen explodiert, in eine Form brachte, die diesen Sprengstoff auch praktisch nutzbar machte. Nobel erfand das Dynamit.
Nitroglycerin wurde erstmals 1847 von dem italienischen Arzt und Chemiker ASCANIO SOBRERO hergestellt [1]. ALFRED NOBEL (Bild links) ist es zu verdanken, dass er diese Flüssigkeit, die schon bei geringsten Erschütterungen explodiert, in eine Form brachte, die diesen Sprengstoff auch praktisch nutzbar machte. Nobel erfand das Dynamit.
Nitroglycerin findet auch in der Medizin Verwendung. Geringste Mengen erweitern die Herzkranzgefäße, so dass es als Spray gegen Angina pectoris im Akutfall benutzt werden kann. Das Spray enthält noch weitere Stoffe wie z.B. Ethanol. Sprüht man es unter die Zunge, so wirkt es augenblicklich. Es verursacht jedoch in der Regel starke Kopfschmerzen.
------------------------
- [1] ASCANIO SOBRERO, Wikipedia; am 22.4.12 abgerufen



 Nötige Vorkenntnisse - Links
Nötige Vorkenntnisse - Links Ein Ester entsteht, wenn man eine Carbonsäure mit einem Alkohol reagieren lässt. Bei dieser Reaktion wird ein Wassermolekül abgespalten (
Ein Ester entsteht, wenn man eine Carbonsäure mit einem Alkohol reagieren lässt. Bei dieser Reaktion wird ein Wassermolekül abgespalten (
 Lernziele - Links
Lernziele - Links Anknüpfungen - Links
Anknüpfungen - Links