Seifen
 |
Fetthärtung |
Orientierung |
|
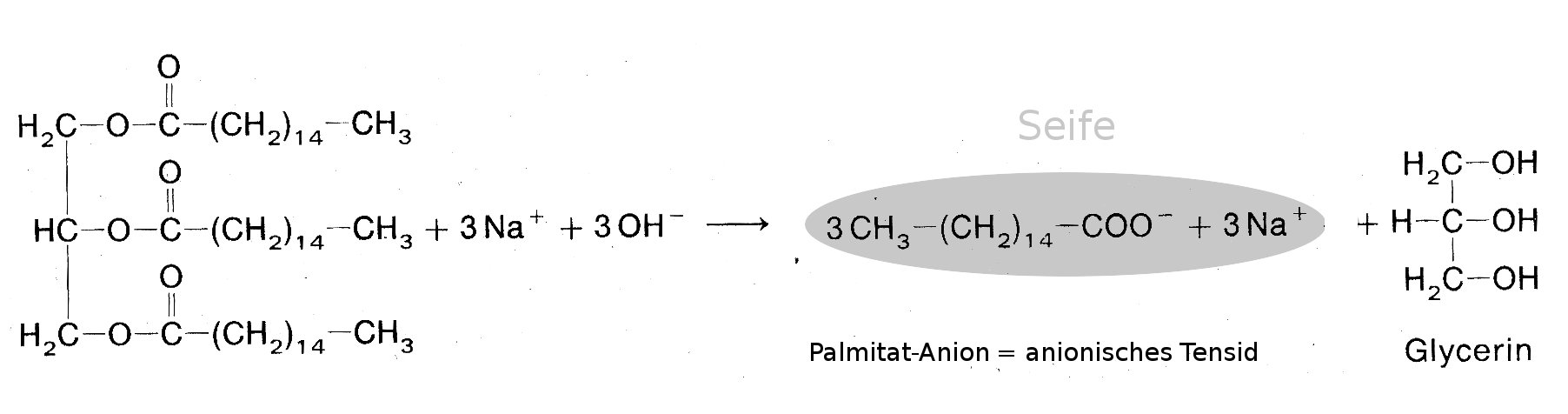
Durch Erhitzen in alkalischen Lösungen werden Fette (Fettsäureglycerinester) in den Alkohol Glycerin und Fettsäurereste (Anionen) gespalten. Diesen Vorgang nennt man Verseifung. Die Fettsäure-Anionen bilden mit Kationen Salze. Die Salze der Fettsäuren nennt man Seife. Natriumsalze der Fettsäuren bilden die Kernseife, Kaliumsalze der Fettsäuren bilden die Schmierseife.
Beispiel: Verseifung von Palmitin (Triglycerinester der Palmitinsäure) mit Natronlauge
Alkalische Lösungen erhält man z.B.
- mit Natriumhydrogencarbonat (Natron):
Natriumhydrogencarbonat + Wasser → Natriumcarbonat + Wasser + Kohlenstoffdioxid
2 NaHCO3 + H2O → Na2CO3 + H2O + CO2
Zwar bildet Kohlenstoffdioxid mit Wasser die schwache Kohlensäure (H2CO3), doch Natriumcarbonat (Soda) bildet mit Wasser die Natronlauge:
Natriumcarbonat + Wasser → Natriumhydrogencarbonat + Natronlauge
Na2CO3 + H2O → NaHCO3 + NaOH
Eine 10%ige Natronlösung hat dadurch einen pH-Wert von 8. Die Lösung kann alkalischer werden, wenn Kohlenstoffdioxid vermehrt aus der Lösung entweicht. Das geschieht durch Erhitzen der Lösung.
- mit Natriumcarbonat (Soda):
Wie man an dem Reaktionsschema oben sehen erkennt, kann man auch gleich Natriumcarbonat verwenden.
Entscheidend ist die Einstellung des folgendes Gleichgewichtes:
CO32-(aq) + H2O(l) ![]() HCO3- + OH-(aq)
HCO3- + OH-(aq)
- mit Kaliumcarbonat (Pottasche):
Kaliumcarbonat + Wasser → Kaliumhydrogencarbonat + Kaliumlauge (Kalilauge)
K2CO3 + H2O → KHCO3 + KOH
- mit faulendem Urin:
Die Römer reinigten stark verschmutzte Wolle mit faulendem Urin. Urin enthält Harnstoff. Bei der Hydrolyse entsteht eine Lösung von Ammoniumcarbonat. Die Lösung reagiert alkalisch und riecht nach Ammoniak.
CO(NH2)2(aq) + 2 H2O(l) → (NH4)2CO3(aq)
NH4+(aq) + CO32-(aq) ![]() NH3(aq) + HCO3-(aq)
NH3(aq) + HCO3-(aq)
Ammoniak kann Protonen aufnehmen, ist also nach Brönsted eine Base:
NH3(aq) + H2O(l) ![]() NH4+(aq) + OH-(aq)
NH4+(aq) + OH-(aq)
Fette können aber auch gleich mit Natronlauge oder Kalilauge verseift werden (Neutralisationsreaktion).