Exkurs für Profis
Die Reaktion im Detail
Im Kapitel "Säuren reagieren mit unedlen Metallen" haben wir festgestellt, dass bei diesem Reaktionstyp neben einem Salz auch das Gas Wasserstoff entsteht. So reagiert Natrium mit Salzsäure zu Natriumchlorid und Wasserstoff:
Unedle Metalle reagieren mit Wasserstoff-Ionen (Protonen), die aus einer beliebigen Säure stammen können, indem sie Elektronen abgeben:
Jeweils zwei Wasserstoff-Atome bilden sofort ein Wasserstoff-Molekül:
Doch bei der Reaktion von Natrium mit Wasser ist keine Säure im Spiel, die Wasserstoff-Ionen geben könnte. Wasser ist doch keine Säure - oder etwa doch?
Die Autoprotolyse des Wassers
Wasser dissoziiert (aufgrund der Elektronegativitätsdifferenz zwischen Wasserstoff- und Sauerstoff-Atomen) tatsächlich zu Wasserstoff-Ionen und Hydroxid-Ionen. Allerdings liegt das Gleichgewicht sehr stark auf der linken Seite. Reines Wasser hat einen pH-Wert von 7, ist also neutral, da die gleiche Menge an Wasserstoff-Ionen und Hydroxid-Ionen vorhanden ist. Offensichtlich neutralisieren sich beide Teilchenarten.
Wahrscheinlicher ist daher folgender Ablauf:
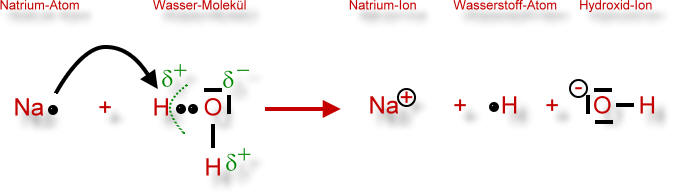
Das Bestreben des Natrium-Atoms, sein einziges Valenzelektron abzugeben ist sehr groß, da das hierbei entstehende Natrium-Ion eine voll besetzte Valenzschale erhält. Das Elektron (e-) des Natrium-Atoms "springt" also zum partiell positiv geladenen Wasserstoff-Atom des Wassermoleküls (entgegen gesetzte Ladungen ziehen sich immer an). Es entsteht ein Natrium-Ion, also ein Kation. Gleichzeitig wird ein Wasserstoff-Atom vom Wasser-Molekül abgespalten. Einzelne Wasserstoff-Atome, die so entstehen, nennt man auch Wasserstoff-Atome "in statu nascendi" (lat, im Zustand der Geburt). Sie sind sehr reaktionsfreudig, da auch sie eine voll besetzte Valenzschale anstreben. Dies erreichen sie durch Kombination mit einem anderen Wasserstoff-Atom, indem sie gemeinsam die Bindungselektronen benutzen (Atombindung). Siehe oben.