Synthese aus den Elementen
Allgemein Unedle Metalle + Nichtmetall → Salz /exotherm
Beispiele
Wortreaktionsschemata
a) Eisen + Sauerstoff → Eisen(II)-oxid /exotherm [Siehe auch: Oxidationsreihe der Metalle]
b) Eisen + Schwefel → Eisen(II)-sulfid /exotherm [Siehe auch:]
c) Aluminium + Brom → Aluminiumbromid /exotherm [Siehe auch: Salzbildungsart (1) aus Klasse 8]
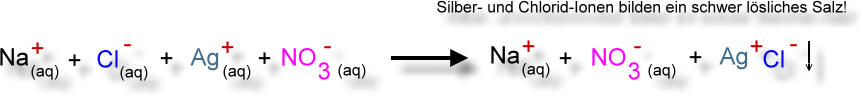
d) Natrium + Chlor → Natriumchlorid /exotherm [Siehe auch: Natriumchloridsynthese aus Klasse 8]
Reaktionsschemata in Symbolformelschreibweise
zu a) 2 Fe + O2 → 2 FeO /exotherm
zu b) Fe + S → FeS /exotherm
zu c) 2 Al + 3 Br2 → 2 AlBr3 /exotherm
zu d) 2 Na + Cl2 → 2 NaCl /exotherm
Reaktionsschemata in Ionenformelschreibweise
zu a) 2 Fe + O2 → 2 Fe2+O2- /exotherm
zu b) Fe + S → Fe2+S2- /exotherm
zu c) 2 Al + 3 Br2 → 2 Al3+Br3- /exotherm
zu d) 2 Na + Cl2 → 2 Na+Cl- /exotherm
Reaktionsschemata in detaillierter Ionenformelschreibweise
... gibt es in diesem Fall nicht, da kein Wasser zugegen ist.
Bei der Bildung dieser Salze nach diesem Schema, werden Elektronen von einer Atomart (Element) auf eine andere Atomart (anderes Element) übertragen. Aus Atomen werden Ionen! Deshalb nennt man diese Salzbildungsart: Synthese eines Salzes aus den Elementen.