Isomerie
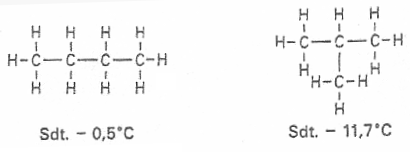
Zu der Summenformel eines Butan-Moleküls (C4H10) lassen sich zwei verschiedene Strukturformeln aufstellen:
Diese beiden Stoffe besitzen unterschiedliche Eigenschaften (Siedetemperaturen) und sind damit auch unterschiedliche Stoffe. Demzufolge muss man sie auch unterschiedlich benennen, obwohl die beiden Moleküle die gleiche Summenformel und demzufolge auch die gleiche Masse haben.
 Moleküle mit gleicher Summenformel aber unterschiedlicher Strukturformel werden Isomere genannt.
Moleküle mit gleicher Summenformel aber unterschiedlicher Strukturformel werden Isomere genannt.
Als n-Alkane (n, wie normal) bezeichnet man die unverzweigten Alkane; iso-Alkane ist hingegen die allgemeine Bezeichnung für verzweigte Alkane.
Beispiel:
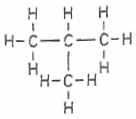
Dies ist also ein Molekül des iso-Butans, da das Molekül verzweigt ist und insgesamt 4 Kohlenstoff-Atome besitzt.
Der systematische Name hingegen ist 2-Methyl-propan. Stammname Propan, weil die längste "Kohlenstoff-Kette" aus drei Kohlenstoff-Atomen besteht.
 Gibt es von einem Alkan verschiedene Molekülstrukturen, so zählen alle diese Stoffe als Isomere.
Gibt es von einem Alkan verschiedene Molekülstrukturen, so zählen alle diese Stoffe als Isomere.
Also:
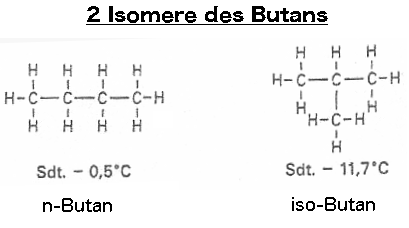 Warum diese beiden Stoffe oben eine unterschiedliche Siedetemperatur haben ist leicht erklärt: Die van-der-Waals-Kräfte sind sowohl von der Masse abhängig, die ja bei den beiden Stoffen gleich ist, als auch von der Größe der Berührungsflächen, die die Moleküle untereinander haben können. Das rechte Molekül besitzt eher eine kugelförmige Gestalt. Kugeln, die sich berühren besitzen eine kleine Berührungsfläche. Demzufolge sind die van-der-Waals-Kräfte in diesem Fall etwas geringer. Die geradkettigen Moleküle besitzen größere Berührungsflächen. Deshalb halten die Moleküle sich stärker fest und es muss mehr Energie aufgewendet werden, um die Moleküle in den gasförmigen Zustand zu bringen, also ist in diesem Fall die Siedetemperatur etwas höher.
Warum diese beiden Stoffe oben eine unterschiedliche Siedetemperatur haben ist leicht erklärt: Die van-der-Waals-Kräfte sind sowohl von der Masse abhängig, die ja bei den beiden Stoffen gleich ist, als auch von der Größe der Berührungsflächen, die die Moleküle untereinander haben können. Das rechte Molekül besitzt eher eine kugelförmige Gestalt. Kugeln, die sich berühren besitzen eine kleine Berührungsfläche. Demzufolge sind die van-der-Waals-Kräfte in diesem Fall etwas geringer. Die geradkettigen Moleküle besitzen größere Berührungsflächen. Deshalb halten die Moleküle sich stärker fest und es muss mehr Energie aufgewendet werden, um die Moleküle in den gasförmigen Zustand zu bringen, also ist in diesem Fall die Siedetemperatur etwas höher.