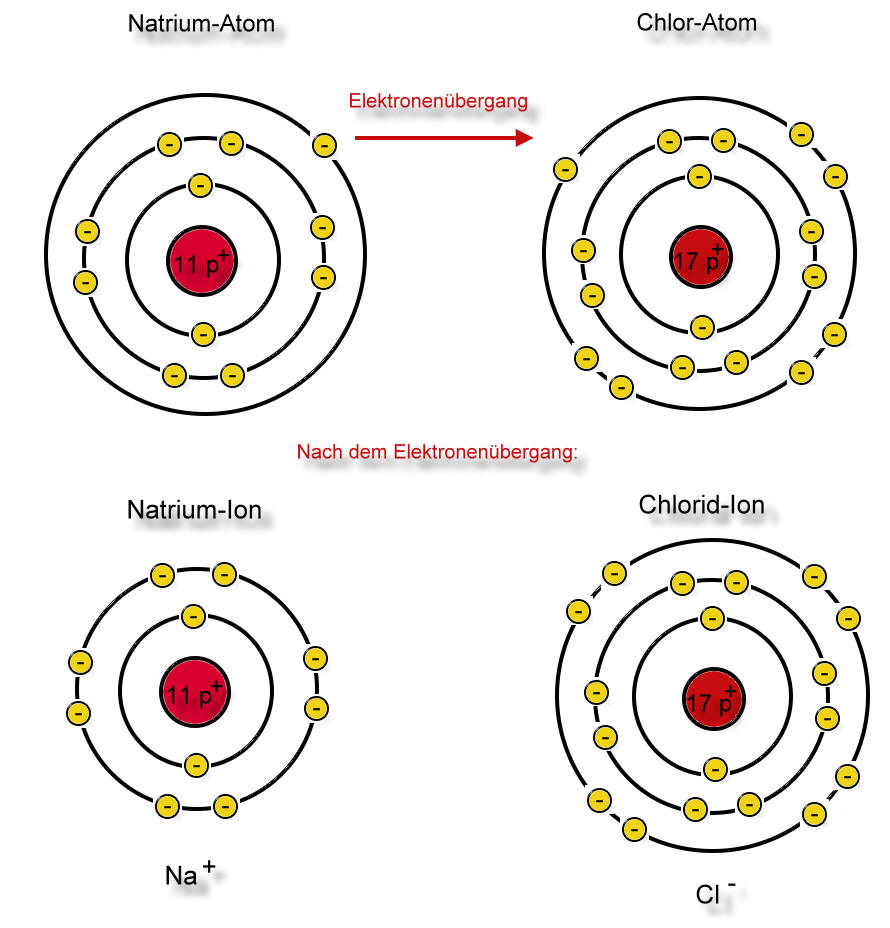
Die Natriumchloridsynthese im Schalenmodell
Noch deutlicher wird es, wenn man nur die äußeren Schalen betrachtet:
Das Natrium-Atom gibt dem Chloratom sein einziges Valenzelektron ab. Eine Schale existiert nur, wenn sich auch Elektronen auf ihr befinden. Jetzt besitzt also das Natrium-Atom eine Schale weniger, die ist jedoch mit Elektronen voll besetzt (EdelgaskonfigurationLex). Nun hat aber das Natrium-Atom 11 Protonen und nur 10 Elektronen. Eine positive Ladung ist zuviel. Eine wichtige Eigenschaft des Teilchens hat sich verändert: Das Teilchen ist nach außen hin einfach positiv geladen. Dieses Teilchen nennt man Natrium-Ion (Schreibweise: Na+). Es hat völlig andere Eigenschaften als die Natrium-Atome des Elementes Natrium.
Auf der anderen Seite konnte das Chlor-Atom durch die Aufnahme eines Elektrons seine Schale voll besetzen. Das entstandene Teilchen ist einfach negativ geladen (17 Protonen, 18 Elektronen) und wird Chlorid-Ion genannt (Schreibweise: Cl-).
Kationen und Anionen ziehen sich aufgrund der unterschiedlichen Ladung an und halten dann fest zusammen. Diesen Zusammenhalt nennt man Ionenbindung. Dazu mehr auf der nächsten Seite.