Um die Vorgänge beim Lösen verstehen zu können, müssen wir uns noch einmal ein Wasser-
Molekül näher betrachten.
Den Bau (die Struktur) eines Wassermoleküls haben wir uns schon einmal erarbeitet.
 Diese Vorkenntnisse noch einmal zusammengefasst:
Diese Vorkenntnisse noch einmal zusammengefasst:
Ein Wasser-Molekül besitzt verschiedene Pole: Auf der einen Seite einen Minus-Pol durch die (negative Partialladung), auf der anderen Seite einen Pluspol (durch die positiven Partialladungen).

 Valenzstrichformel:
Valenzstrichformel: 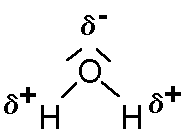
Es handelt sich bei den Polen der Wassermoleküle nicht um ganze positiv oder negativ geladene Bereiche (wie z.B. bei den Ionen) sondern um positive bzw. negative Teilladungen, auch Partialladungen genannt. Hintergrund ist die sogenannte Lex, die in der oben erwähnten Unterrichtseinheit schon erläutert wurde.
Diese Teilladungen sind also viel schwächer als die Ladungen von Ionen.
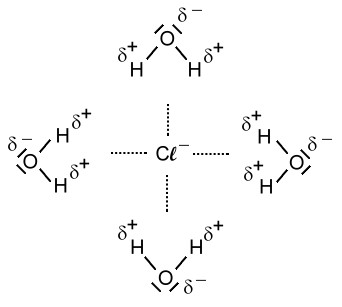
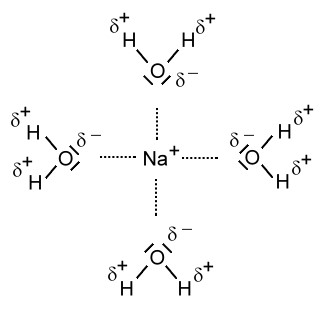
Beim Lösevorgang werden die Seiten der Wassermoleküle mit der positiven Partialladung von den Anionen, also im Falle des Natriumchlorids von den Chlorid-Ionen, angezogen. Die Seite eines Wassermoleküls mit der negativen Partialladung wird von den Kationen, also im Falle des Natriumchlorids von den Natrium-Ionen, angezogen.
Modell:
Die Anziehungskraft eines Wassermoleküls reicht nicht aus, um ein Ion aus dem Kristallverband heraus zu brechen. Da sich jedoch stets mehrere Wasser-Moleküle an einem Ion anlagern - besonders an den Ecken des Kristalls - , summiert sich die Anziehungskraft. Schließlich werden die Ionen aus dem Kristallgitter heraus gebrochenen. Dieses "Herausbrechen" benötigt Energie, die als Wärmeenergie dem Lösemittel entzogen wird.
Danach werden die Ionen von den Wassermolekülen umhüllt. Diesen Prozess nennt man allgemein Solvatation. Im Falle des Lösemittels Wasser spricht man von Hydration oder Hydratation. Hierbei wird Energie frei, die so genannte Hydrationsenergie (oder auch: Hydratationsenergie).
 Der Begriff ist leicht mit Hydratisierung zu verwechseln; vor allem, weil in der englischen Sprache kein Unterschied zwischen Hydratation und Hydratisierung gemacht wird.
Der Begriff ist leicht mit Hydratisierung zu verwechseln; vor allem, weil in der englischen Sprache kein Unterschied zwischen Hydratation und Hydratisierung gemacht wird.
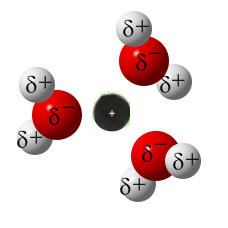
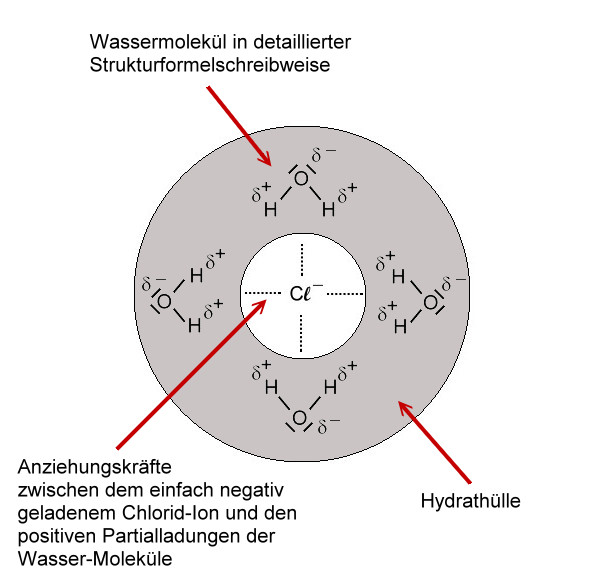
Hydratisierte Ionen:
Nun sind die Ionen durch Wassermoleküle "geschützt". Diese "Hülle" nennt man auch Hydrathülle. Es wirken nach außen nur noch die schwachen Teilladungen der Wassermoleküle. Diese schwachen Anziehungskräfte, die nun nach außen wirken, reichen nicht aus, als dass sich die entgegengesetzt geladenen Ionen wieder anziehen können. Die Ionen "schwimmen" nun also frei beweglich im Wasser rum und können sich verteilen. Da die Ionen selbst so winzig klein sind, können wir sie nicht sehen. Nach dem Lösevorgang des Salzes ist das Salz für uns im Wasser nicht mehr sichtbar.
Modell:
Modell in Formelschreibweise:
 Wie viele Wassermoleküle umhüllen denn ein Ion?
Wie viele Wassermoleküle umhüllen denn ein Ion?
Die Anzahl an Wasser-Molekülen (Hydratationszahl), die sich um ein Ion anlagern, hängt von der Größe des Ions und von seiner Ladung ab. Ein kleines, z.B. 2-fach geladenes Kation, kann mehr Wasser-Moleküle anziehen, als ein großes, 1-fach geladenes Kation.
Die Abbildungen oben geben nicht die wahre Anzahl der Wasser-Moleküle wieder, zumal die Zeichnungen den Sachverhalt ja auch nur zweidimensional wiedergeben.
Übrigens bilden die Wasser-Moleküle mehrere Schichten um ein Ion. Hierbei ist die Anziehungskraft der ersten Schicht (primäre Hydratation) am größten (Ionen-Dipol-Wechselwirkung). Die weiteren Schichten werden durch "Wasserstoffbrücken" zusammengehalten.
Hydratationszahlen einiger Ionen [1]:
| Ion |
Zahl der Wassermoleküle |
| Li+ |
12 |
| Na+ |
8 |
| K+ |
4 |
| Mg2+ |
14 |
| Ca2+ |
10-12 |
| Cl- |
3 |
| Br- |
2 |
---------------------------------
[1] Quelle: Römpp USB Stick · 2008, ISBN: 978-3-13-149231-9
 Löst sich in heißem und kaltem Wasser die gleiche Menge an Speisesalz?
Löst sich in heißem und kaltem Wasser die gleiche Menge an Speisesalz?
Bei den meisten Salzen ist es so, dass sich in heißem Wasser einen größere Menge löst. Natriumchlorid, also unser Speisesalz, stellt hier jedoch einen Ausnahme dar: Die Menge, die sich in heißem und kaltem Wasser löst, ist fast gleich [2].

Die Zeit, die man braucht, bis sich die gesättigte Salzlösung einstellt, ist jedoch
abhängig von der Temperatur und vom Rührvorgang.
[2] http://www.chemie.de/lexikon/Natriumchlorid.html
: 356 g/l bei 0°C, 358 g/l bei 22°C. Oder : http://www.wasser-wissen.de/abwasserlexikon/n/natriumchlorid.htm
: 391 g/l bei 99°C
Würde man nun solch eine Salzlösung eindampfen oder verdunsten lassen, so gehen die Wassermoleküle in den gasförmigen Zustand über, die Hydrathüllen fallen weg und die Ionen können sich wieder anziehen und ein Ionengitter bilden. Nach dem Verdampfen des Wassers sehen wir wieder das Salz.
Durch das Eindampfen von gesättigten Salzlösungen wurde früher in den Salzsiedereien aus den Solequellen das Speisesalz gewonnen. In südlichen Ländern wird durch Verdunsten von Meerwasser heute noch Speisesalz nach diesem Prinzip gewonnen:
 Warum gibt es leicht- und schwerlösliche Salze?
Warum gibt es leicht- und schwerlösliche Salze?
Ist die Hydrationsenergie größer als die Gitterenergie, so ist in der Regel ein Salz löslich und das Wasser erwärmt sich (exothermer Lösevorgang). Ist die Gitterenergie viel größer als die Hydrationssenergie, so ist ein Salz in der Regel schwer löslich. Viele Salze lösen sich jedoch unter Abkühlung des Wassers. Bei diesen Salzen ist die Gitterenergie nur etwas größer als die Hydrationsenergie. Die fehlende Energiemenge wird dem Wasser entzogen: Das Wasser kühlt sich ab (endothermer Lösevorgang). Beim Natriumchlorid ist die Hydrationsenergie und die Gitterenergie etwa gleich. Demzufolge ändert sich die Temperatur des Wassers beim Lösen nur geringfügig.
Man kann den Lösevorgang von Natriumchlorid in Wasser mit folgendem "Reaktionsschema" beschreiben:
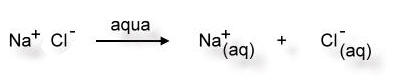
aqua = lat. Wasser
(aq) = Hydrathülle
(Beachte aber, dass hierbei keine neuen Stoffe entstehen. Der Begriff "Reaktionsschema" ist hier irreführend.)
Das Trennen der Ionen aus dem Ionengitter nennt man auch
Dissoziation. Man sagt: Das Salz
dissoziiert im Wasser.
 Siehe dir auch an, warum sich bestimmte Stoffe nicht in Wasser lösen können.
Siehe dir auch an, warum sich bestimmte Stoffe nicht in Wasser lösen können.




 Valenzstrichformel:
Valenzstrichformel: 





 Siehe dir auch an, warum sich bestimmte Stoffe nicht in Wasser lösen können.
Siehe dir auch an, warum sich bestimmte Stoffe nicht in Wasser lösen können.





