Was weiß ich jetzt über Salze?
Mit Hilfe des Schalenmodells bist du nun in der Lage die chemische Reaktion von einem Halogen (gehört zur Elementfamilie der Nichtmetalle) mit einem Metall (-Element) zu einem Salz auf der Teilchenebene erklären zu können:
Metallatome besitzen wenig Valenzelektronen und geben diese gerne ab um eine Edelgaskonfiguration zu erreichen. Dabei entsteht ein neuer Stoff: ein Metall-Ion (Kation). Kationen sind immer positiv geladen.
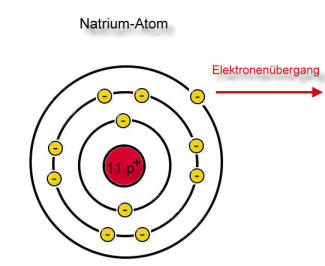
Nichtmetall-Atome besitzen schon viele Valenzelektronen und möchten gerne die Valenzschale zur Edelgaskonfiguration auffüllen. So entsteht aus einem Nichtmetall-Atom ein Nichtmetall-Ion (Anion). Anionen sind immer negativ geladen.
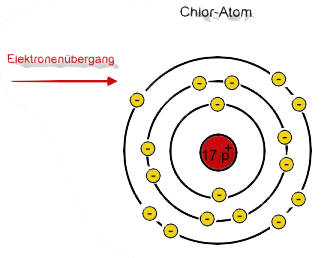
Wie viel Elektronen sich bei einem Element auf der Valenzschale befinden, kannst du aus dem PSE heraus lesen. Die römische Hauptgruppenzahl gibt die Anzahl an. Die Periode, also die Zeilenzahl im PSE gibt dir Auskunft über die Anzahl der Schalen.
Auch mit Hilfe des Kugelwolkenmodells lässt sich die Synthese von Natriumchlorid gut erklären:
Bildung von Natrium- und Chlorid-Ionen

Der rote Pfeil soll den Elektronensprung verdeutlichen!
Kationen (die positiv geladenen Metall-Ionen) und Anionen (die negativ geladenen Nichtmetall-Ionen) ziehen sich an (Ionen-Bindung) und bilden ein Ionengitter: Es ist ein Salz in kristalliner Form entstanden.
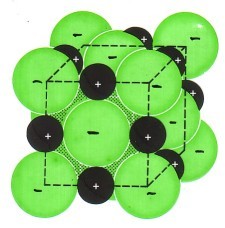
Alle typischen Eigenschaften der Salze (z.B. hohe Schmelztemperatur) lassen sich auf die sehr starken Ionenbindungen zurückführen!
Da Wasser ein polares Lösemittel ist, können die Wasser-Moleküle besonders an den Ecken des Salzkristalls Ionen "heraus brechen". Anschließend werden die Ionen von Wassermolekülen umhüllt (Hydrathülle). Jetzt können sich die Ionen nicht mehr gegenseitig anziehen. Sie verteilen sich im Lösemittel und sind für unsere Augen nicht mehr sichtbar.
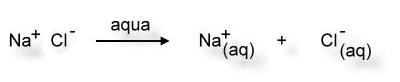
aqua = lat. Wasser
(aq) = Hydrathülle
Andere wichtige Halogenide außer Kochsalz sind Fluoride (für den Zahnschmelz) und Iodide (für die Schilddrüse).
Natrium-, Kalium-, Calcium- und Magnesium-Ionen spielen eine außerordentlich große Rolle in biochemischen Prozessen. Ionen, die unser Körper braucht, nennt man auch Mineralstoffe!
Bestimmte Kationen kann man mit der Flammenprobe nachweisen. Chlorid-Ionen (z.B. im Trinkwasser) können mit der Silbernitratprobe nachgewiesen werden.





