Die Löslichkeit von Carbonsäuren in Wasser
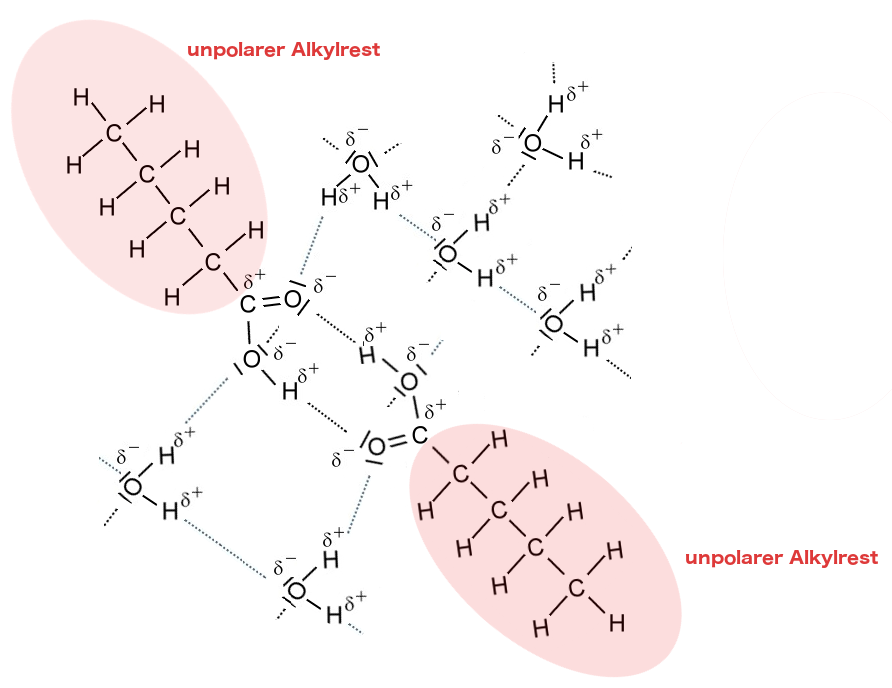
Nur die ersten vier Carbonsäuren aus der homologen Reihe sind in Wasser löslich. Das liegt daran, dass der Einfluss des unpolaren Alkylrestes mit zunehmender Kettenlänge zunimmt und die Wirkung der polaren Carboxy-Gruppe in den Hintergrund drängt.
Wasser ist ein polares Lösemittel. Die Wassermoleküle sind Dipolmoleküle und können daher untereinander "Wasserstoffbrücken" ausbilden. Das führt dazu, dass sich die Wassermoleküle gegenseitig anziehen und damit nicht zulassen, dass sich unpolare Moleküle zwischen sie drängen. Die polaren Wassermoleküle können sich nur mit anderen polaren Molekülen nach dem Prinzip "Ähnliches löst sich in Ähnlichem" mischen, weil sie nur mit diesen "Wasserstoffbrücken" ausbilden können.
Da sich der unpolare Alkyl-Rest immer von den Wassermolekülen weg orientiert, entsteht schließlich eine Phasengrenzschicht zwischen dem Wasser und dem vorwiegend unpolaren Stoff, hier also der langkettigen Carbonsäure.
 Siehe dir auch folgende Themen an:
Siehe dir auch folgende Themen an: