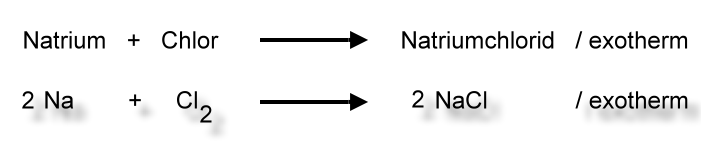
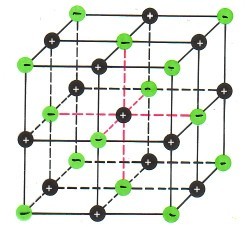
Zwei außergewöhnliche Elemente reagieren zu einer lebensnotwendigen Verbindung: Natriumchlorid
Heißes Natrium reagiert mit Chlor unter heftiger Lichtentwicklung zu einem weißen,
salzartigen Stoff: Natriumchlorid.
YouTube-Video, von RatsChemie am 19.6.08 hochgeladen
Leider sieht man in diesem Video nicht das weiße Reaktionsprodukt: Natriumchlorid. Dies ist in der folgenden Abbildung anders. Bei diesem Versuch wurde durch ein seitlich angebrachten Schlauch das Chlor in das Reagenzglas geleitet.

Bildquelle: Universität Wuppertal; am 6.8.12 aufgerufen
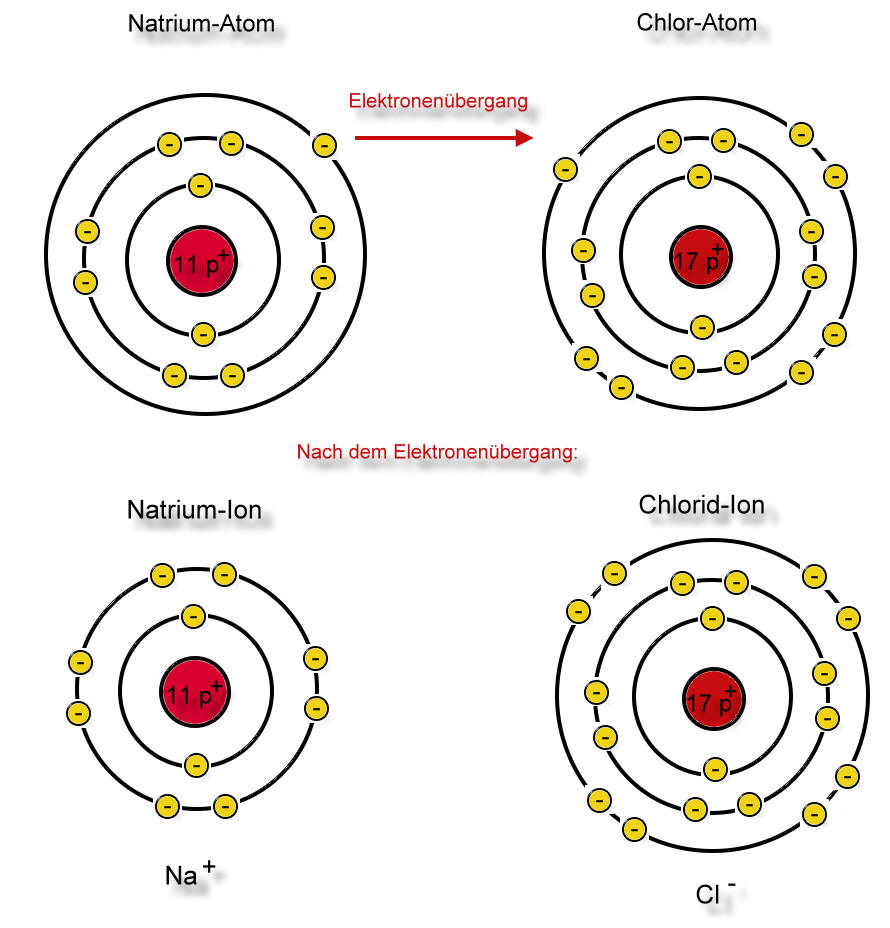
Zwei Natrium-Atome reagieren mit einem Chlor-MolekülLex zu zwei Natriumchlorid-Baueinheiten. Man spricht hier nicht von Natriumchlorid-Molekülen, weil - wie wir noch sehen werden - es sich nach der Reaktion nicht mehr um Atome handelt und diese Teilchen auch nicht durch Atombindungen gebunden sind.