Kinetik
 |
Orientierung |
Einführung

Advanced Organizer
Während wir uns im letzten Unterrichtsblock mit der Energetik von chemischen Reaktionen beschäftigt haben, werden wir uns jetzt mit der Kinetik, also dem zeitlichen Ablauf von chemischen Reaktionen, auseinandersetzen.
Natürlich weiß jeder, dass Lebensmittel in der Sonne schneller verderben als im Kühlschrank. Aber woran liegt das? Warum reift ein Apfel so langsam? Und warum reift eine Banane schneller, wenn sie neben einem Apfel liegt? Warum ist das Rosten von Eisen ein langsamer Prozess und warum sind Reaktionen wie die Knallgasreaktion oder andere Explosionen schnelle Reaktionen? Was versteht man eigentlich genau unter dem Begriff Reaktionsgeschwindigkeit? Von welchen Faktoren hängt die Reaktionsgeschwindigkeit ab? Wie kann man Reaktionsgeschwindigkeiten messen?
Mit solchen Fragen werden wir uns in diesem Kapitel beschäftigen.
Die Katalyse gehört zu den Schlüsseltechnologien des 21. Jahrhunderts.
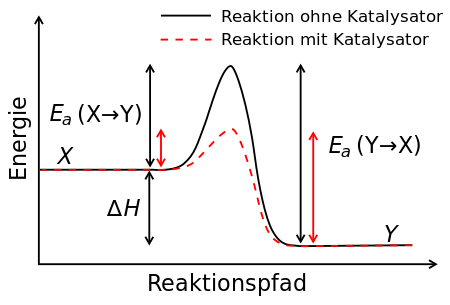
Katalysatoren sind Stoffe, welche die Aktivierungsenergie zum Ablauf einer bestimmten Reaktion herabsetzen und dadurch die Reaktionsgeschwindigkeit erhöhen, ohne bei der Reaktion verbraucht zu werden. Ein Katalysator geht (scheinbar) unverändert aus der Reaktion hervor.
Neben der Anwendung bei Kraftfahrzeugen zum Abbau von Schadstoffen steuern Katalysatoren heute schon mehr als 80% aller großtechnischen Prozesse in der chemischen Industrie. Da durch Katalysatoren die Aktivierungsenergie gesenkt wird, wird auch Energie eingespart und damit der Energieausstoß in die Umwelt geringer. Außerdem spielen Katalysatoren in der Natur, z.B. für die Energiegewinnung biologischer Prozesse, eine wichtige Rolle.
Lernziele / Kompetenzen
 Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links
Phänomene
Gesetzmäßigkeiten anwenden, Phänomene deuten, Reaktionsschemata aufstellen (Summenformeln, Ionenformelschreibweise, Strukturformeln)
Zusammenfassung
Zusammenfassung - Links
- Als Reaktionsgeschwindigkeit bezeichnet man den Quotienten der Änderung der Konzentration eines Reaktionspartners und dem betrachteten Zeitintervall.
- Die Geschwindigkeit einer Reaktion ist nicht konstant, da sie konzentrationsabhängig ist. Spielen bei einer Reaktion Gase eine Rolle, so kann der Gasdruck auch Einfluss auf die Reaktionsgeschwindigkeit haben.
- Man kann die durchschnittliche Geschwindigkeit für ein Zeitintervall mit v = Δc(Produkte)/Δt angeben oder die Momentangeschwindigkeit zu einem bestimmten Zeitpunkt durch den Differenzialquotienten v = dc/dt. Von besonderer Bedeutung ist die Anfangsgeschwindigkeit einer chemischen Reaktion.
- Um Stoffkonzentrationen zu einem bestimmten Zeitpunkt einer Reaktion berechnen zu können, muss das Geschwindigkeitsgesetz der Reaktion experimentell ermittelt werden, also die Reaktionsordnung bestimmt werden.
- Die Halbwertszeit einer Reaktion ist die Zeit, nach der im Verlauf der chemischen Reaktion genau die Hälfte der ursprünglichen Stoffmenge umgesetzt wurde.
- Chemische Reaktionen finden statt, wenn die Teilchen mit genügend großer Energie in in einem bestimmten Winkel aufeinander stoßen (Stoßtheorie). Mit steigender Temperatur nimmt der Anteil an wirksamen Zusammenstöße zu. Daher steigt die Reaktionsgeschwindigkeit auch mit zunehmender Temperatur. Oft gilt, dass sich die Reaktionsgeschwindigkeit verdoppelt oder vervierfacht, wenn die Temperatur um 10 K erhöht wird (RGT-Regel).
- Die Reaktionsgeschwindigkeit ist von der Art des Stoffes abhängig. So reagieren unedle Metalle schneller mit Säuren, als edle Metalle.
- Die Reaktionsgeschwindigkeit ist von der Phasengrenzfläche bei heterogenen Ausgangsstoffen abhängig bzw. vom Zerteilungsgrad abhängig. Auch mechanische Faktoren wie z.B. der Effekt des Schüttels kann die Reaktionsgeschwindigkeit beeinflussen.
- Ein Katalysator erhöht die Reaktionsgeschwindigkeit durch Herabsetzung der Aktivierungsenergie und geht unverändert aus der Reaktion wieder hervor (daher wird er bei einem Reaktionsschema weder auf der Edukt-Seite noch auf der Produkt-Seite notiert, sondern über dem Reaktionspfeil).




 Anknüpfungen - Links
Anknüpfungen - Links