Die Löslichkeit der Alkane
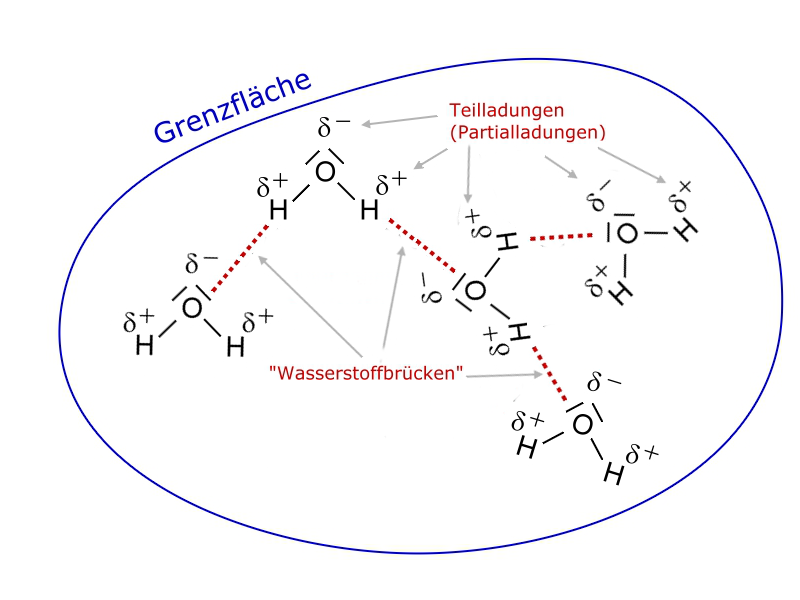
Polare Flüssigkeiten wie Wasser bilden untereinander "Wasserstoffbrücken" (siehe auch hier). Die Wassermoleküle haben also aufgrund dieser zwischenmolekularen Wechselwirkungen eine große Zuneigung zusammen zu bleiben (siehe auch Oberflächenspannung des Wassers).
Die polaren Wassermoleküle lassen es nicht zu, dass sich unpolare Moleküle zwischen sie drängen, weil sie gerne aufgrund der "Wasserstoffbrücken" zusammenbleiben wollen.
Sollten unpolare Alkanmoleküle durch Schütteln zwischen Wassermoleküle geraten sein, so entsteht nur für kurze Zeit ein Gemisch. Danach drängen die Wassermoleküle beim Zusammenkommen die Alkanmoleküle wieder nach außen weg. Emulgatoren (wie z.B. Eigelb) sind in der Lage diese Trennung zu verhindern.
Da diese zwischenmolekularen Kräfte zueinander ausgerichtet sind, wirken sie an der Grenzfläche des Wassers nicht nach außen. Unpolare Stoffe wie die Alkane, aber auch Fette und Öle, können durch diese Grenzfläche nicht eindringen - sie sind in Wasser unlöslich. Anders ausgedrückt: Die Wasser- und die Alkanmoleküle können sich nicht mischen.
Untereinander sind Alkane - bei gleichem Aggregatzustand - in jedem Verhältnis mischbar. Alkane sind lipophil bzw. hydrophob. Das heißt, sie sind in unpolaren Stoffen wie Fetten und Ölen löslich, nicht jedoch in Wasser.
 Merke: Ähnliches löst sich in Ähnlichem.
Merke: Ähnliches löst sich in Ähnlichem.
So löst sich Trinkalkohol gut in Wasser, da Trinkalkohol (Ethanol) ebenfalls polar ist.
 Siehe dir auch an, wie man sich den Lösevorgang eines Salzes in Wasser vorstellen kann:
Siehe dir auch an, wie man sich den Lösevorgang eines Salzes in Wasser vorstellen kann:
- Der Lösevorgang eines Salzes in Wasser
Oder wie es sich mit der Löslichkeit bei Carbonsäuren verhält:
- Die Löslichkeit von Carbonsäuren in Wasser