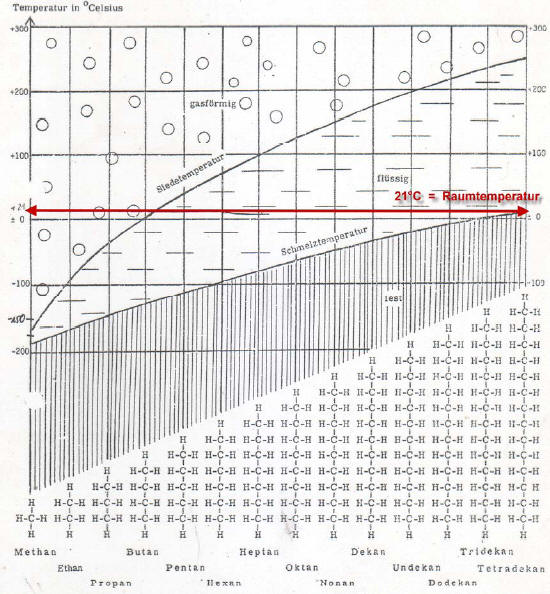
Siede- und Schmelzpunkte in der homologen Reihe der n-Alkane
Quelle: Unbekannt (noch aus meiner eigenen Schulzeit)
Die Schmelztemperaturkurve ist stark vereinfacht.
Tatsächlich gibt es hier zwischen den Alkanen mit gerader und ungerader Anzahl an Kohlenstoff-Atomen Sprünge.
Um den Sachverhalt zu verdeutlichen, wurden im Diagramm die Temperaturpunkte zu einer Temperaturkurve verbunden.
Folgende Aussagen kann man dem Diagramm entnehmen:
- Fachsprache: In dem Diagramm sind die Siede- und Schmelzpunkte der ersten vierzehn n-Alkane gegen deren Kettenlänge, also gegen ihre Molekülmassen aufgetragen.
- Mit steigender Molekülmasse steigt auch der Schmelz- und Siedepunkt.
- Der Anstieg der Siedepunkte ist größer als der Anstieg der Schmelzpunkte.
- Bei Raumtemperatur liegen die ersten vier n-Alkane der homologen Reihe gasförmig vor, die n-Alkane Pentan bis Tridecan sind bei Raumtemperatur hingegen flüssig.
[Hier ist das Diagramm jedoch leider etwas ungenau! Erst ab 17 Kohlenstoffatomen sind die n-Alkane fest. Die Alkane davor sind zähflüssig (viskos).