Struktur der Aminosäuren
Ein Molekül einer Aminosäure (Aminocarbonsäure) besitzt zwei funktionellen Gruppen.
- Eine Amino-Gruppe und
- eine Carboxy-Gruppe (=funktionelle Gruppe der Carbonsäuren).
Diese beiden funktionellen Gruppen sind über ein (asymmetrischen) Kohlenstoff-Atom verbunden, wie man an der Strukturformel unten sehen kann.
Detaillierte Strukturformel
R bezeichnet die sogenannte Seitenkette eines Aminosäure-Moleküls, durch die sich alle Aminosäuren in ihren physikalischen und chemischen Eigenschaften voneinander unterscheiden.
Modell

Glycin ist die einfachste Aminosäure (R=H)
Das Modell wurde mit dem Struktomat gezeichnet.
Summenformel bzw. Verhältnisformel
Glycin: C2H5NO2
Alanin: C3H7NO2
Summenformeln
Glycin: NH2CH2COOH
Alanin: NH2CHCH3COOH
Die Aminogruppe für Profis
Amine kann man sich aus einem Ammoniak-Molekül hergestellt vorstellen, indem die Wasserstoff-Atome des Ammoniaks durch einen Alkylrest (R = Kohlenwasserstoff-Kette) ersetzt wurden. Je nachdem, wie viele Wasserstoff-Atome ersetzt wurden, unterscheidet man zwischen primären, sekundären und tertiären Aminen.
Ammoniak:  primäres Amin:
primäres Amin:  sekundäres Amin:
sekundäres Amin: 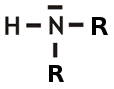
Eine Amino-Gruppe ist der Teil -NH2 eines primären Amins. Eine Amino-Gruppe ist eine basische Gruppe, da sich am Stickstoff-Atom ein freies, nicht bindendes Elektronenpaar befindet.
Bei einem Amid (eigentlich Säureamid) ist R ein Carbonsäure-Rest, also -COO-.
Die für den Biologen wichtigen proteinogenen 20 unterschiedlichen Aminosäuren unterscheiden sich lediglich in dem Aminosäure-Rest (Seitenkette; R) am mittleren Kohlenstoff-Atom, welches auch α-Kohlenstoff-Atom genannt wird. Da sich die Amino-Gruppe an diesem α-Kohlenstoff-Atom befindet, werden diese Aminosäuren auch als α-Aminosäuren bezeichnet (2-Aminocarbonsäuren). Näheres zur Namensgebung (Nomenklatur) siehe auch weiter unten.
Wenn der Aminosäure-Rest kein Wasserstoff-Atom ist, dann sind am mittleren α-Kohlenstoff-Atom vier unterschiedliche Atome bzw. Atomgruppierungen gebunden. Solche Kohlenstoff-Atome nennt man asymmetrisch. Sie können mit einem kleinen Sternchen * gekennzeichnet werden.
Der Aminosäure-Rest, also die Seitenkette, hat großen Einfluss auf die chemischen und physikalischen Eigenschaften der Aminosäure.
So verleihen unpolare Seitenketten, also Seitenketten, die nur aus Kohlenstoff- und Wasserstoff-Atomen bestehen, einer Aminosäure hydrophobe Eigenschaften. Solche Seitenketten können sich zusammenlagern und auf diese Weise einen wasserfreien Raum im Protein bilden. In solchen Räumen können dann chemische Reaktionen ablaufen, die kein wässriges Milieu mögen. Unpolare, also lipophile Seitenketten können in Membranen, die ebenfalls lipophil sind, verankert werden.
Saure Aminosäuren besitzen in der Seitenkette eine zusätzliche Carboxy-Gruppe, die Wasserstoff-Ionen (Protonen) abgeben können; basische Aminosäuren besitzen in der Seitenkette eine zusätzliche Amino-Gruppe, die Protonen aufnehmen kann (Brönsted-Base). Unter physiologischen Bedingungen besitzen die sauren und basischen Seitenketten Ladungen, wodurch sie stark hydrophil sind.
Von Bedeutung sind auch proteinogene Aminosäuren, die ein Schwefel-Atom besitzen. Hierzu gehören die Aminosäuren Cystein (Cys) und Methionin (Met). Sie verleihen den Proteinen eine bestimmte räumliche Struktur.
In neutraler wässeriger Lösung und in festem Zustand liegen Aminosäuren als Zwitterionen vor.


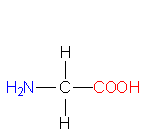 bzw.
bzw. 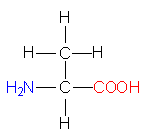 bzw.
bzw. 

