Eigenschaften und Verwendungsmöglichkeiten
Schmelz- und Siedepunkte
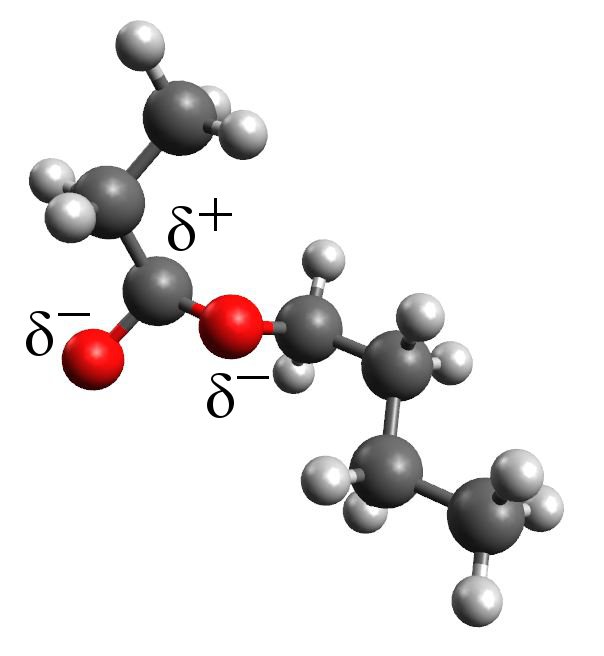
Ester haben niedrigere Schmelz- und Siedepunkte als z.B. Carbonsäuren oder Alkohole. Dies liegt daran, dass Ester insgesamt kaum polar sind. Sie können also untereinander keine Wasserstoffbrücken ausbilden.
Zur allgemeinen Diskussion hierzu siehe auch das Thema "Siedepunkte der Alkanole".
Löslichkeit
Ester sind aufgrund der geringen Polarität schwer oder gar nicht in Wasser löslich. Die stark polaren Wassermoleküle ziehen sich sehr stark an. Dabei werden die recht unpolaren Estermoleküle bzw. die unpolaren Bereiche der Estermoleküle gewissenmaßen weggedrängt. Es kommt somit zu einer räumlichen Trennung von Ester und Wasser.
Brennbarkeit
Ester sind leicht entzündlich und brennbar. Auch dies liegt an der geringen Polarität. Einzelne Moleküle können aus dem Stoff entweichen. An einzelne Moleküle kann der Luftsauerstoff von allen Seiten heran.
Geruch
Weil Ester leicht flüchtig sind (siehe oben), gelangen einzelne Moleküle auch leicht in unsere Nase.
Dichte
Ester haben eine geringere Dichte als Wasser (Ausnahme: Ameisensäuremethylester). Im übrigen ist dies auch ein Grund für die Unlöslichkeit in Wasser.







Kommentare
Der Text war sehr hilfreich !