Siedetemperaturen (Siedepunkte) / Verdunstungsprozesse
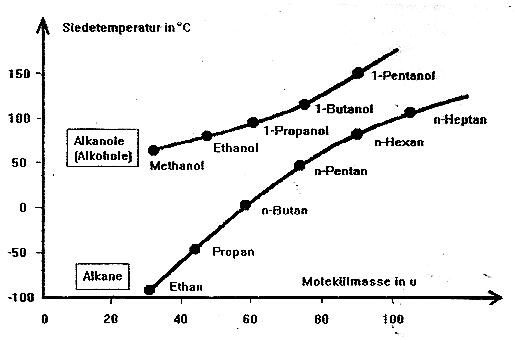
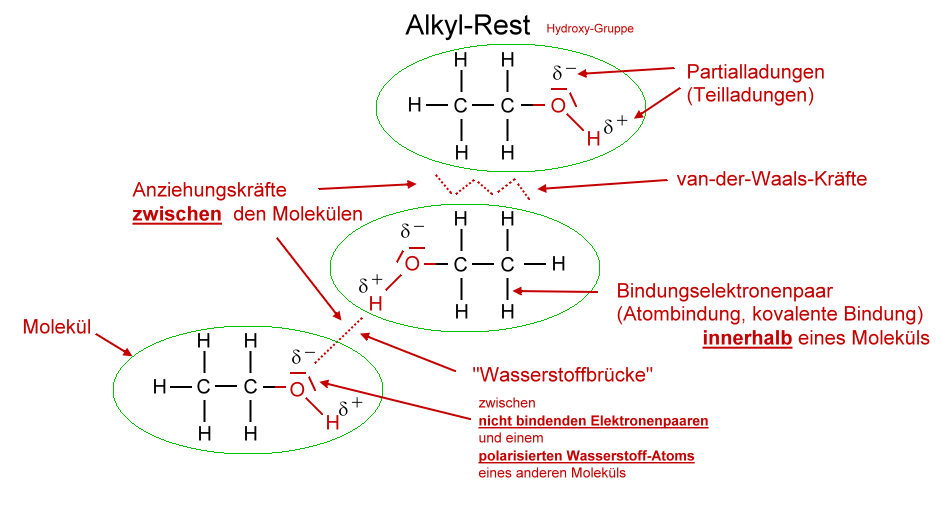
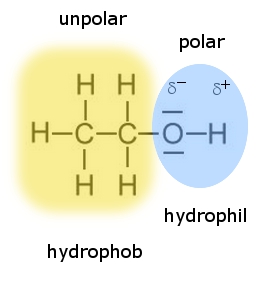
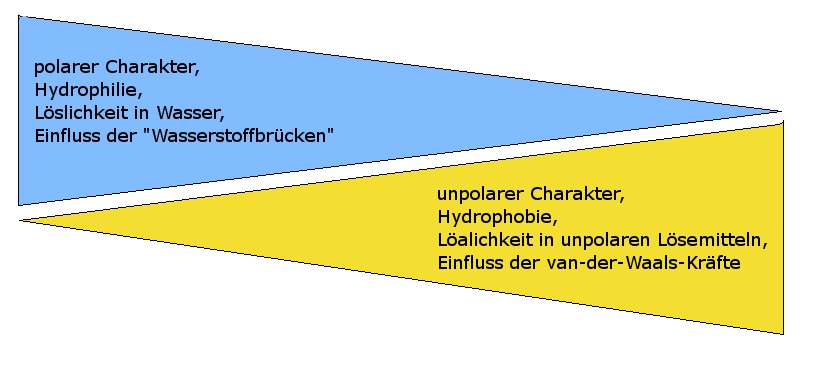
Die außergewöhnlich hohen Siedetemperaturen der Alkanole (im Vergleich zu den Alkanen mit ähnlicher Molekülmasse) liegen in der funktionellen Gruppe der Alkanole begründet. Aufgrund der polaren Hydroxy-Gruppe können die Alkohol-Moleküle untereinander (zusätzlich zu den recht schwachen van-der-Waals-Kräften) recht starke "Wasserstoffbrücken" ausbilden. Da sich dadurch die Moleküle stärker anziehen, muss mehr Energie zugefügt werden, bis die Moleküle eine Geschwindigkeit erreicht haben, die es ihnen ermöglicht von der flüssigen Phase in die gasförmige Phase zu wechseln.
Zum besseren Verständnis solltest du auch die Diskussion über das Siedeverhalten der Alkane noch einmal wiederholen.
Verdunstungsprozesse
Folgende Alkohole haben einen niedrigeren Siedepunkt als Wasser:
| Methanol | 65°C | |
| Ethanol | 78°C | |
| Propan-2-ol (Isopropylalkohol) | 82°C | |
| Propan-1-ol | 97°C |
Die Angaben sind gerundet.
In diesem Zusammenhang wird auch klar, warum sich diese Alkohole auf der Haut kühl anfühlen: Die verdunstenden Moleküle nehmen die Wärme der Haut mit. Der Chemiker sagt auch: Die für die Verdunstung notwendige Energie wird der Haut entzogen.
- Die kühlende Wirkung einiger Duschgels beruht auf diesen Effekt.