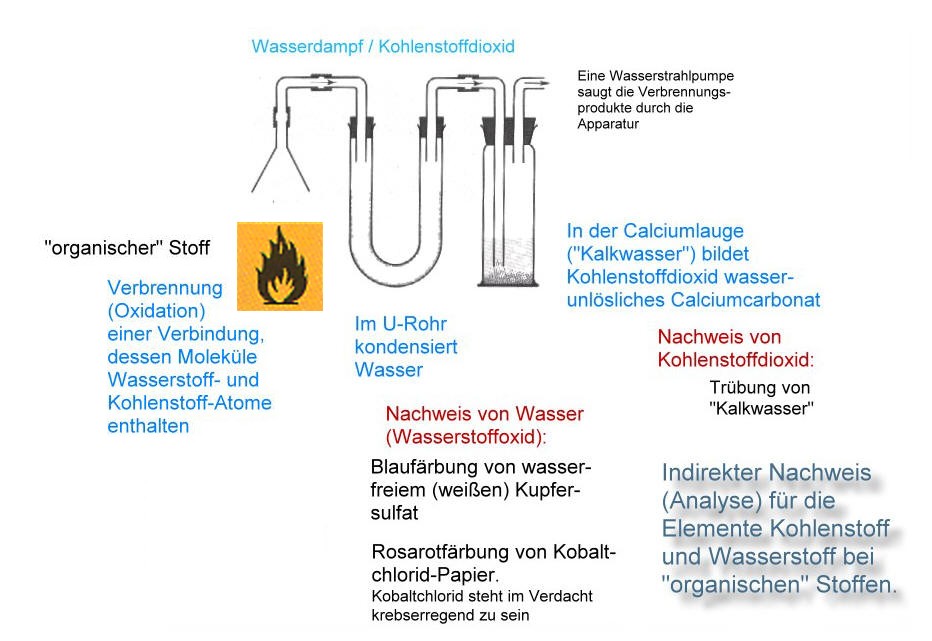
Hypothese: Im Trinkalkohol-Molekül sind Sauerstoff-Atome enthalten!
Vorüberlegungen:
- Wir wollen einen möglichst einfachen Versuchsaufbau - wenn es geht: im Reagenzglas.
- Wenn Trinkalkohol Sauerstoff-Atome enthält, müsste man dem Trinkalkohol durch ein Reduktionsmittel den Sauerstoff entziehen können. Dazu brauchen wir ein unedles Metall wie Magnesium.

- Wenn also Magnesiumoxid entsteht, welches bekannterweise ein weißes Pulver ist und im Turnunterricht verwendet wird, sollten wir uns vergewissern, dass es sich wirklich um Magnesiumoxid handelt. Möglicherweise bildet ein anderes Element des Alkohols mit dem Magnesium ein weißes Pulver. Wie weise ich aber Magnesiumoxid nach? Aus dem Unterricht ist bekannt, dass Magnesiumoxid mit Wasser zu Magnesiumlauge reagiert. Magnesiumlauge ist eine sehr schwache Lauge und kann mit dem Indikator Phenolphthalein durch Rosafärbung nachgewiesen werden (der Universalindikator ist zu unempfindlich).
- Das Magnesium darf nicht mit dem Luftsauerstoff reagieren sondern nur mit den (hypothetischen) Sauerstoff-Atomen des Trinkalkohols. Ansonsten hätten wir den Luftsauerstoff nachgewiesen.
- Würde eine Verbrennung des Alkohols mit dem Sauerstoff der Luft stattfinden, dann würden natürlich - wie bei allen organischen Verbindungen - die sauerstoffhaltigen Verbindungen CO2 und H2O entstehen. Kohlenstoffdioxid wird durch Magnesium jedoch reduziert: Es entsteht Magnesiumoxid. Auch hierbei hätten wir den Sauerstoff der Luft nachgewiesen.
Lösung: Fluten der Apparatur mit Stickstoff (inertes Gas).
Wenn kein Stickstoff in der Schule vorhanden ist, muss sichergestellt sein, das sich nur Trinkalkohol (und Magnesium) in der Apparatur befindet. Dies ist gegeben, wenn man viel Trinkalkoholdampf in der Apparatur hat, der die Luft verdrängt hat.
- Günstig müsste der Versuch laufen, wenn man fein verteilten Alkohol mit Magnesium reagieren lässt. Du weißt noch aus der Unterrichtseinheit Feuer (8. Klasse), dass eine große Oberfläche eine Reaktion begünstigt. Man müsste also Alkoholdampf erzeugen. Dort sind die Alkohol-Moleküle fein verteilt. Außerdem gelangen auf diese Art die Alkohol-Moleküle in der Apparatur an das Magnesium.
Lösung: Verwendung von Sand.
Die Verwendung von Sand ist ein Trick: Da Sand Wärme speichern kann und sie gleichmäßig wieder abgeben kann, wenn keine Wärmezufuhr mehr stattfindet, kann sich kontinuierlich Alkoholdampf bilden - auch, wenn man kurz den Brenner entfernt.
Lösung: Erhitzen von Magnesium bis zur Glut. Die Glut liefert genug Aktivierungsenergie.
Versuchsaufbau

Versuchsdurchführung
In dem Reagenzglas befindet sich mit Trinkalkohol getränkter Sand und Magnesium.
Das Magnesium wird bis zur Glut erhitzt (1), zugleich wird durch schwaches Erwärmen Alkoholdampf erzeugt (2) (Bedenke nochmals: Trinkalkohol wird nicht - wie beim Versuch vorher - verbrannt! Es ändert sich nur der Aggregatzustand).
Wenn das Magnesium aufglüht, wird nur noch die Dampfentwicklung des Trinkalkohols fortgesetzt. Das austretende Gas wird entzündet. Nach Abschluss des Experimentes wird der feste Rückstand in Wasser gegeben und mit Phenolphthalein geprüft.
Versuchsbeobachtungen
- Es entsteht ein weißes Pulver, also ein neuer Stoff (=> chemische Reaktion)
- Das weiße Pulver lässt im Wasser das Phenolphthalein rosa färben.
- Schwarze Färbung des Sandes oder/und auf dem Magnesiumoxid.
- Ein Stoff oder mehrere Stoffe lassen sich an der Düse entzünden und brennen mit blau-gelber Flamme.
Versuchsauswertung
Im Folgenden Text: grün = Ausgangsstoffe (Edukte); rot = Reaktionsprodukte.
- Magnesium wird bei diesem Versuch zu Magnesiumoxid oxidiert, welches mit Wasser Magnesiumlauge bildet.
Trinkalkohol + Magnesium → Magnesiumoxid
Nachweis von Magnesiumoxid:
Magnesiumoxid + Wasser → Magnesiumhydroxid → Magnesiumlauge
Mg2+O2- + H2O → Mg2+(OH-)2 → Mg2+(aq) + 2 OH-(aq)
(Nachweis von Magnesiumlauge durch Rosafärbung von Phenolphthalein)
- Der für die Bildung von Magnesiumoxid benötigte Sauerstoff muss aus dem Alkoholdampf stammen!
Da das Reagenzglas mit Trinkalkoholdampf gesättigt ist, befindet sich im Reagenzglas auch kein Luftsauerstoff mehr.
- Die Schwarzfärbungen deuten auf das Entstehen von Kohlenstoff hin.
- Die Flamme an der Düse des Reagenzglases entsteht durch überschüssigem Alkoholdampf, aber auch durch den bei der Verbrennung entstandenem Wasserstoff (siehe auch am Anfang dieser Seite). Alkohol und Wasserstoff sind brennbar.
- Das Reaktionsschema für die gesamte Reaktion ist noch nicht aufzustellen, da wir die Summenformel eines Trinkalkohol-Moleküls noch nicht kennen.
Zusammenfassung
In einem Trinkalkohol-Molekül sind die Elemente
- Kohlenstoff,
- Wasserstoff und
- Sauerstoff
gebunden.