Methanol
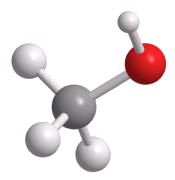 Der einfachste Alkohol ist Methanol. Im Alkyl-Rest befindet sich nur ein Kohlenstoff-Atom.
Der einfachste Alkohol ist Methanol. Im Alkyl-Rest befindet sich nur ein Kohlenstoff-Atom.
Verwendung im Alltag:
Methanol ist Ausgangsstoff für wichtige organische Zwischenprodukte. Daher ist Methanol in Deutschland eines der wichtigsten Chemikalien. Er kann weiterhin direkt als Kraftstoff oder in Brennstoffzellen genutzt werden. Außerdem findet Methanol als Lösungs- und Frostschutzmittel Verwendung. Da es beim Auftragen auf Glas keine Schlieren hinterlässt und rückstandslos verdunstet, eignet sich Methanol hervorragend zum Reinigen von Glasgeräten.
Eigenschaften:
Methanol (auch Industriealkohol genannt) ist giftig. Die lebensbedrohliche Dosis liegt bei ca. 1 g pro kg Körpergewicht.
Synthese von Methanol:
Schon im Mittelalter wurde Methanol durch trockene Destillation (= Erhitzen unter Luftabschluss, Pyrolyse) von Laubholz (daher der Trivialname Holzgeist) gewonnen.
Heute kann Methanol aus Erdgas oder aus Synthesegas (Gemisch aus Kohlenstoffmonooxid und Wasserstoff) gewonnen werden:
CO + 2 H2 ![]() CH3OH /ΔH°298 = -90,8 kJ/mol
CH3OH /ΔH°298 = -90,8 kJ/mol
Hinweis



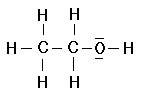 bzw.
bzw. 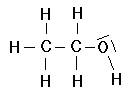
 [
[




