Drei wichtige mehrwertige Alkanole
Ethan-1,2-diol (Glycol)
Glycol ist eine farblose, viskose, süßlich schmeckende, giftige Flüssigkeit. Es wird als Frostschutzmittel, z.B. in Motorkühlern und zur Herstellung von Kunststoffen, Druck- und Stempelfarben verwendet.
Propan-1,2,3-triol (Glycerin)
Summenformel: C3H5(OH)3
Verhältnisformel: C3H8O3
| Strukturformel (Lewisformel, Valenzstrichformel): |
 |
| Halbstrukturformel: | 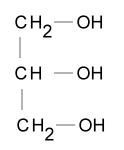 |
| Skelettstrukturformel: | |
| Kalotten-Modell: |  |
Glycerin ist ein ungiftiger mehrwertiger Alkohol. Er kann in Spuren im Blut nachgewiesen werden. Als Zusatz in Cremes, Zahnpasten, Tabak und Druckfarben sorgt das Glycerin wegen seiner hygroskopischen Wirkung für genügend Feuchtigkeit. Es kann als Frostschutzmittel eingesetz werden und findet vor allem Verwendung in der Kunststoff- und Sprengstoffindustrie ("Nitroglycerin" = Dynamit in Kieselgur).
Hexan-1,2,3,4,5,6-hexol (Sorbit)
Sorbit kommt in vielen Früchten vor, vor allem in denen der Rosengewächse (z.B. Eberesche oder Vogelbeere). Es ist ein weißes, kristallines Pulver und wird als Zuckerersatz in der Deabetikerdiät verwendet, da es im Organismus in Fructose und nicht in Glucose umgewandelt wird. Es wird ebenso als Ausgangsstoff für die biotechnologische Gewinnung von Ascorbinsäure (Vitamin C) benutzt.



 Alkohole, die einen niedrigeren Schmelzpunkt als Wasser besitzen, werden auch als
Alkohole, die einen niedrigeren Schmelzpunkt als Wasser besitzen, werden auch als 
