Bleibt Wein lange offen an der Luft stehen, schmeckt er sauer.
Es ist Essig (systematischer Name: Ethansäure) entstanden.
Essigsäurebakterien, die überall in der Luft vohanden sind, haben mit Hilfe des Luftsauerstoffs den Alkohol (Ethanol) des Weines in Essigsäure oxidiert:
CH3CH2OH + O2 → CH3COOH + H2O
In der Lebensmittelindustrie stellt man Essig in riesigen Holzfässern her, die Holzspäne enthalten, die wiederum mit Essigbakterien besiedelt sind. So gewonnener Speiseessig enthält ca. 6% Essigsäure und viele Aromastoffe.
- Reine Essigsäure ist eine klare Flüssigkeit, die bei 17°C zu einer eisartigen Masse erstarrt, weswegen sie auch "Eisessig" genannt wird.
- Essigessenz ist 25%ige Essigsäure. Sie wird in Chemiefabriken hergestellt und darf nicht unverdünnt verwendet werden.
- Tafelessig wird aus verdünntem Kartoffel-, Getreide- oder Zuckerrübenschnaps hergestellt.
- Weinessig wird, wie der Name schon sagt, aus Wein hergestellt und ist besonders aromatisch.
- Obstessig wird überwiegend aus Apfelwein hergestellt und besitzt einen fruchtigen Geschmack.
- Kräuteressig erhält man, wenn man Kräuter und Gewürze längere Zeit in Essig ziehen lässt.
Die wässerige Lösung von Essigsäure, also Essig, verhält sich wie eine "klassische" Säure (siehe 9. Klasse):
- Die Lösung leitet den elektrischen Strom: Hinweis auf das Vorhandensein von frei beweglichen Ionen.
In wässriger Lösung liegen die Alkansäuren also dissoziiert vor. Wie bei allen Säuren nach Arrhenius entstehen dabei die Wasserstoff-Ionen, die für alle Säureeigenschaften verantwortlich sind, und der Säurerest der Essigsäure: Das Acetat-Ion.
CH3COOH 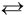 CH3COO-(aq) + H+(aq)
CH3COO-(aq) + H+(aq)
Essigsäure ist eine
schwache Säure: in einer verdünnten Lösung wie im Haushaltsessig haben nur etwa 0,4% der Essigsäure-
Moleküle ein Wasserstoff-Ion abgegeben. In dem Dissoziationsschema oben liegt also das (dynamische) Gleichgewicht stark auf der linken Seite.
Speiseessig hat einen pH-Wert von 3.
Essig wurde im alten Rom als Erfrischungsgetränkt benutzt. Die Soldaten hatten ein Gemisch aus Essig und Wasser in ihren Feldflaschen, um das oft verschmutzte Wasser zu desinfizieren. Essig wurde oft in Bleitöpfen aufbewahrt. Essig reagiert mit Blei zu Bleiacetat. Dieses Salz der Essigsäure ist in Wasser gut löslich, schmeckt süß und wird deshalb als Bleizucker bezeichnet. Allerdings ist es giftig.
Da man in den Skeletten und Zähnen der alten Römer viel Blei gefunden hat, nimmt man heute an, dass eine allgemein verbreitete Beleivergiftung der Bevölkerung mit zum Untergang des römischen Reiches beigetragen hat. Noch im Mittelalter wude Bleizucker zum Süßen verwendet. (Außer dem Honig hatte man einfach keine anderen Möglichkeiten zum Süßen).
Essigsäure reagiert mit Kalk (Calciumcarbonat) zu wasserlöslichem Calciumacetat und Kohlensäure (die zu Wasser und Kohlenstoffdioxid zerfällt).
2 CH3COOH + CaCO3 → Ca2+(CH3COO-)2 + H2O + CO2 ↑
Mit Essig bekommt man also Kalkränder sehr gut weg (Kaltentkalken). Allerdings greift Essigsäure Kupfer und Chrom an. Deshalb benutzt man zum Kaltentkalken oft Citronensäure.
Übrigens: Heißentkalken sollte man mit Citronensäure nicht. Die bildet nämlich in der Hitze mit Kalk schwerlösliches Calciumcitrat!
Aluminiumacetat wird als altes Hausmittel für Umschläge genutzt. Da es desinfizierend und entzündungshemmend wirkt fördert es die Wundheilung.
Molekülstruktur von Ethansäure:
Beim rechten Bild ist der Platz verdeutlicht, den die nicht bindenden Elektronenpaare benötigen.
[Mit dem Struktomat erstellt]
Ethanol lässt sich über das Ethanal (Acetaldehyd) bis zur Ethansäure (Essigsäure) oxidieren:
![]() CH3COO-(aq) + H+(aq)
CH3COO-(aq) + H+(aq)






