Eine Möglichkeit die Elektronenschalen zu untersuchen ist, ein Elektron aus dem Atom zu entfernen und dabei zu messen, wie viel Energie dazu nötig ist. Die Energie die benötigt wird, um Elektronen aus einem Atom zu entfernen, nennt man Ionisierungsenergie, da hierbei aus einem Atom ein Ion wird.
 Wie kann man Elektronen aus einem Atom entfernen?
Wie kann man Elektronen aus einem Atom entfernen?
Lässt man einen Strahl aus schnell fliegenden Elektronen auf ein Gas einwirken, so schlagen diese Elektronen - sofern sie genug Bewegungsenergie haben - Elektronen der Gas-Atome aus ihrer Valenzschale (Hülle). Die Bewegungsenergie der Elektronen, die man für diesen Beschuss benutzt, kann man berechnen.
Erhöht man langsam die Geschwindigkeit der Elektronen bis sich im Gas die ersten Ionen bilden, was man an der Zunahme der elektrischen Leitfähigkeit des Gases messen kann, so entspricht die Energie der Elektronen zu diesem Zeitpunkt der Ionisierungsenergie der Gasatome.
Bei solchen Experimenten kann man Folgendes messen:
- Die Ionisierungsenergie steigt bei einem Element mit jedem weiteren abzuspaltenden Elektron. Hierbei beobachtet man Unregelmäßigkeiten, die auf das Vorhandensein von Schalen hindeuten.
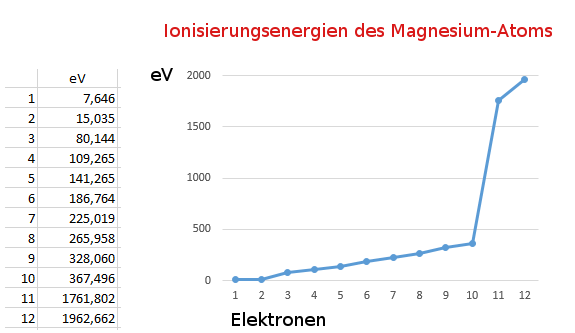
Quelle der Werte: http://www.periodensystem.info/elemente/magnesium/,
am 13.09.15 abgerufen.
Interpretation
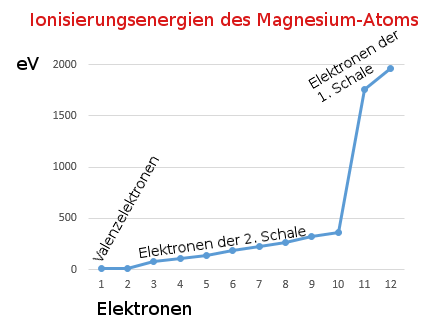 Wenn das erste Elektron vom Atom abgetrennt wird (1. Ionisierungsenergie), bleibt ein Ion zurück. Wegen seiner positiven Ladung zieht es Elektronen besonders stark an. Diese Anziehungskraft muss beim Entfernen eines weiteren Elektrons überwunden werden, was zusätzliche Energie benötigt. Je mehr Elektronen entfernt werden, umso stärker wirkt die positive Ladung des entstehenden Ions, umso stärker wird das nächste Elektron festgehalten.
Wenn das erste Elektron vom Atom abgetrennt wird (1. Ionisierungsenergie), bleibt ein Ion zurück. Wegen seiner positiven Ladung zieht es Elektronen besonders stark an. Diese Anziehungskraft muss beim Entfernen eines weiteren Elektrons überwunden werden, was zusätzliche Energie benötigt. Je mehr Elektronen entfernt werden, umso stärker wirkt die positive Ladung des entstehenden Ions, umso stärker wird das nächste Elektron festgehalten.
Der sprunghafte Anstieg an Energie bei der Abspaltung des dritten und besonders des elften Elektrons weist darauf hin, dass diese Elektronen einer Schale angehören, die sich näher am Atomkern befindet und damit auch stärker festgehalten werden. Nach dem Schalenmodell besitzt das Magnesium-Atom drei Schalen.
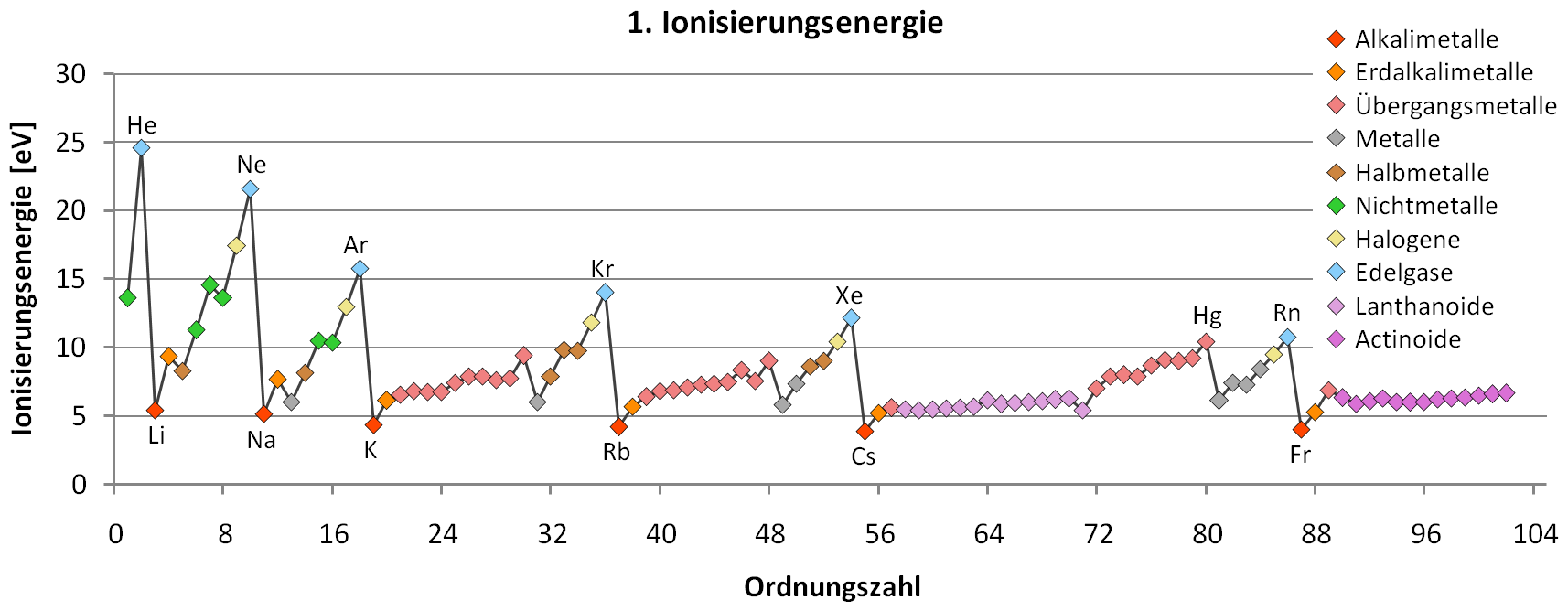
- Vergleicht man die 1. Ionisierungsenergie aller Elemente miteinander, so fällt Folgendes auf:
Bildquelle: https://commons.wikimedia.org/wiki/File: Erste_Ionisierungsenergie_PSE_color_coded.png, am 13.09.15 abgerufen.
- Mit steigender Protonenzahl (Ordnungszahl) innerhalb einer Periode steigt die 1. Ionisierungsenergie.
Interpretation
Mit steigender Protonenzahl (Kernladung) muss offensichtlich die Anziehungskraft zwischen dem Atomkern und dem bei der Ionisierung zu entfernenden Elektron stärker sein. Je größer die Kernladung, desto größer die Anziehungskraft.
Nimmt man das Schalenmodell, so muss man davon ausgehen, dass die Valenzschalen mit zunehmender Kernladungszahl also enger am Kern liegen. Die Anziehungskraft des Kernes nimmt mit zunehmender Kernladungszahl innerhalb einer Periode zu, die Elektronen werden immer stärker angezogen. Das hat zur Folge, dass sich die Atomradien entsprechend ändern. Für die nun dichter am Kern gelegenen Elektronen sind die Ionisierungsenergien höher. Für eine bestimmte Anzahl an Elektronen ist die gegenseitige Abstoßung auf so engem Raum dann so groß, dass sich in diesem Bereich keine weiteren Elektronen aufhalten können: Eine neue, vom Kern weiter gelegene Schale steht dann einem zusätzlichen Elektron zur Verfügung - eine neue Periode beginnt.
- Innerhalb einer Gruppe sinkt die 1. Ionisierungsenergie von oben nach unten im PSE.
Interpretation
Der Abstand zwischen Kern und Elektron wird mit jeder neuen Schale immer größer. Die gegenseitige Abstoßung der Elektronen auf einer inneren Schale ist nach außen gerichtet, was sich am meisten auf die Valenzelektronen auswirkt: Sie sind deutlich weiter vom Kern entfernt. Damit ist für die Ionisierunge eines Valenzelektrons wie z.B. bei Li und Na sehr viel weniger Energie nötig als bei den jeweils vorangegangenen Elementen.
Es kommt noch ein weiterer Effekt zum Tragen: Die inneren Schalen schirmen die außen sitzenden Valenzelektronen vom Einfluss des Kerns ab, wodurch die Anziehungskraft auf die Valenzelektronen geschwächt wird.
- Problem 1: Es gibt Unregelmäßigkeiten, die mit dem Schalenmodell nicht mehr erklärt werden können:
Bildquelle: https://commons.wikimedia.org/wiki/File: Erste_Ionisierungsenergie_PSE_color_coded.png, am 13.09.15 abgerufen, von mir verändert (Pfeile)
Einige dieser Unregelmäßigkeiten sind hier in der Abbildung durch Pfeile gekennzeichnet: So erkennt man z.B. bei Bor, Sauerstoff, Aluminium, Schwefel, Gallium und Indium auffällig niedrige 1. Ionisierungsenergien. Schauen wir uns einmal die Unregelmäßigkeit um das Element Gallium genauer an:
| Element |
Protonenzahl |
1. Schale |
2. Schale |
3. Schale |
4. Schale |
1. Ionisierungsenergie |
| Zn |
30p+ |
2e- |
8e- |
18e- |
2e- |
9,394 eV |
| Ga |
31p+ |
2e- |
8e- |
18e- |
3e- |
5,999 eV |
| Ge |
32p+ |
2e- |
8e- |
18e- |
4e- |
7,898 eV |
Vergleicht man die Elektronenkonfigurationen mit den entsprechenden Ionisierungsenergien, so wird nicht klar, wieso Gallium so eine niedrige 1. Ionisierungsenergie besitzt.
-
- Problem 2: Elektronenkonfiguration der Nebengruppenelemente
| Element |
Protonenzahl |
1. Schale |
2. Schale |
3. Schale |
4. Schale |
| Ca |
20p+ |
2e- |
8e- |
8e- |
2e- |
| Sc |
21p+ |
2e- |
8e- |
9e- |
2e- |
| ... |
... |
... |
... |
↓ |
2e- |
| Zn |
30p+ |
2e- |
8e- |
18e- |
2e- |
Bei den Nebengruppenelementen (Übergangsmetalle) wird zuerst die 3. Schale bis zu 18 Elektronen aufgefüllt, obwohl sich diese Elemente in der 4. Periode befinden. Erst danach wird ab dem Germanium (s.o.) die 4. Schale weiter aufgefüllt.
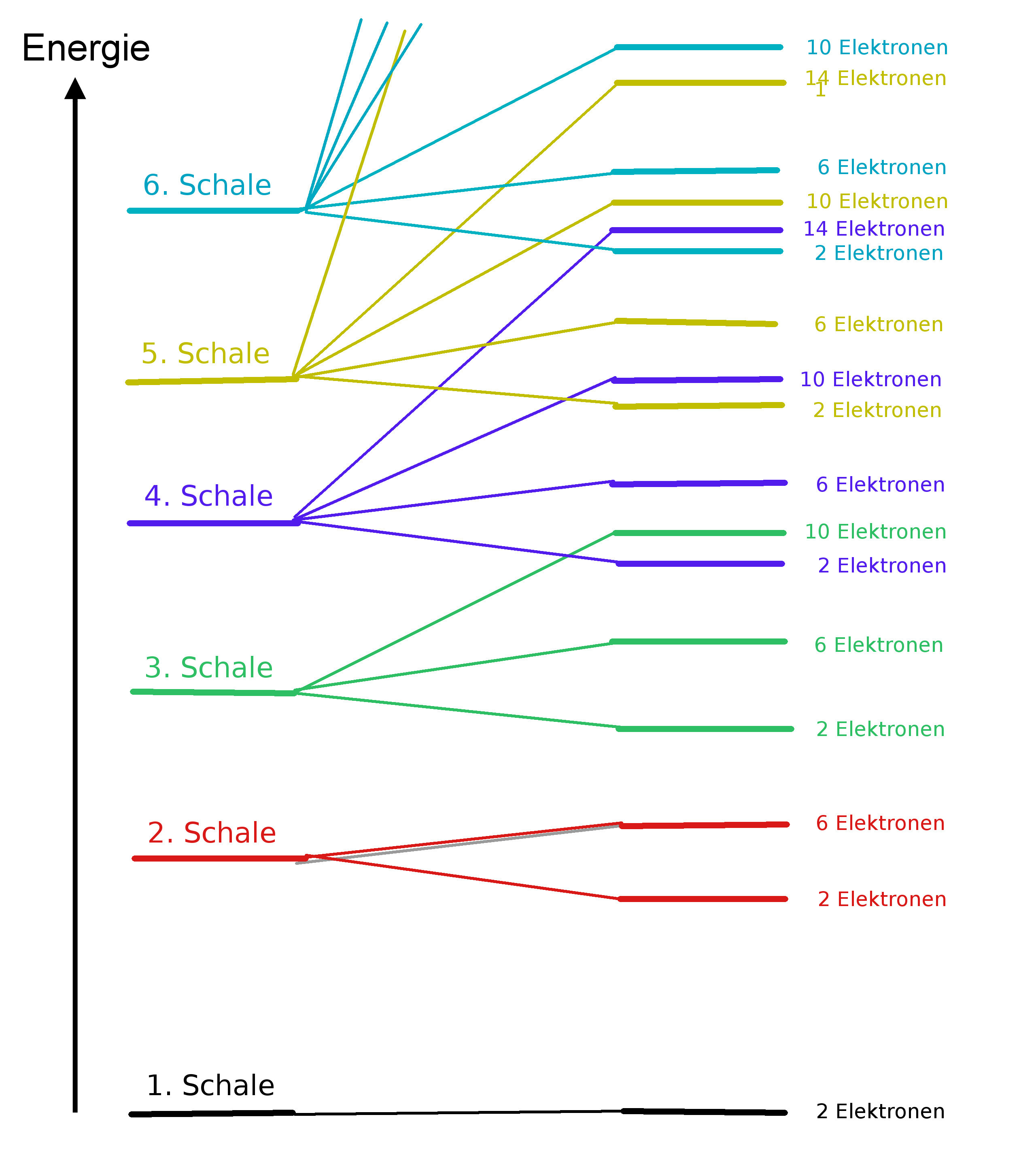
 Elektronen sind verschieden stark an dem Kern gebunden. Man spricht von unterschiedlichen Energieniveaus der Elektronen. Je stärker ein Elektron an dem Kern gebunden ist, umso tiefer ist seine Energie - es befindet sich also auf einem niedrigeren Energieniveau. Einem stärker gebundenen Elektron muss man mehr Energie zufügen (Ionisierungsenergie), um es vom Atom zu entfernen, als einem schwächer gebundenen. Das schwächer gebundene Elektron befindet sich auf einem höheren Niveau, besitzt also schon mehr Energie - und benötigt deshalb eine geringere Energiezufuhr zur Entfernung.
Elektronen sind verschieden stark an dem Kern gebunden. Man spricht von unterschiedlichen Energieniveaus der Elektronen. Je stärker ein Elektron an dem Kern gebunden ist, umso tiefer ist seine Energie - es befindet sich also auf einem niedrigeren Energieniveau. Einem stärker gebundenen Elektron muss man mehr Energie zufügen (Ionisierungsenergie), um es vom Atom zu entfernen, als einem schwächer gebundenen. Das schwächer gebundene Elektron befindet sich auf einem höheren Niveau, besitzt also schon mehr Energie - und benötigt deshalb eine geringere Energiezufuhr zur Entfernung.
Folgendes Diagramm zeigt diese Energieniveaus:
Die 7. Schale wurde der Übersicht halber weg gelassen.
Bei diesem Diagramm wird deutlich, das sich die Energieniveaus z.T. überschneiden. Das Schalenmodell bietet hier keinen Erklärungsansatz.
 Elektronen sind verschieden stark an dem Kern gebunden. Man spricht von unterschiedlichen Energieniveaus der Elektronen. Je stärker ein Elektron an dem Kern gebunden ist, umso tiefer ist seine Energie - es befindet sich also auf einem niedrigeren Energieniveau. Einem stärker gebundenen Elektron muss man mehr Energie zufügen (Ionisierungsenergie), um es vom Atom zu entfernen, als einem schwächer gebundenen. Das schwächer gebundene Elektron befindet sich auf einem höheren Niveau, besitzt also schon mehr Energie - und benötigt deshalb eine geringere Energiezufuhr zur Entfernung.
Elektronen sind verschieden stark an dem Kern gebunden. Man spricht von unterschiedlichen Energieniveaus der Elektronen. Je stärker ein Elektron an dem Kern gebunden ist, umso tiefer ist seine Energie - es befindet sich also auf einem niedrigeren Energieniveau. Einem stärker gebundenen Elektron muss man mehr Energie zufügen (Ionisierungsenergie), um es vom Atom zu entfernen, als einem schwächer gebundenen. Das schwächer gebundene Elektron befindet sich auf einem höheren Niveau, besitzt also schon mehr Energie - und benötigt deshalb eine geringere Energiezufuhr zur Entfernung.
 Wenn das erste Elektron vom Atom abgetrennt wird (1. Ionisierungsenergie), bleibt ein Ion zurück. Wegen seiner positiven Ladung zieht es Elektronen besonders stark an. Diese Anziehungskraft muss beim Entfernen eines weiteren Elektrons überwunden werden, was zusätzliche Energie benötigt. Je mehr Elektronen entfernt werden, umso stärker wirkt die positive Ladung des entstehenden Ions, umso stärker wird das nächste Elektron festgehalten.
Wenn das erste Elektron vom Atom abgetrennt wird (1. Ionisierungsenergie), bleibt ein Ion zurück. Wegen seiner positiven Ladung zieht es Elektronen besonders stark an. Diese Anziehungskraft muss beim Entfernen eines weiteren Elektrons überwunden werden, was zusätzliche Energie benötigt. Je mehr Elektronen entfernt werden, umso stärker wirkt die positive Ladung des entstehenden Ions, umso stärker wird das nächste Elektron festgehalten.