Sprunghafte Strahlungsübergänge
Wir hatten bei der Flammenfärbung (Nachweis von Metall-Ionen) schon gesehen, dass Metalle bzw. Metall-Ionen ganz bestimmte Flammenfarben in der nicht leuchtenden Gasbrennerflamme erzeugen. Erklärt wurde das damit, dass Elektronen beim Erhitzen auf ein höheres Energieniveau "springen", dort aber nur für sehr kurze Zeit verweilen können und dann beim Zurückspringen wieder Energie in Form von Licht abgeben.
In der Gasphase zum Leuchten angeregte Elemente bzw. Ionen erzeugen also Licht ganz bestimmter Wellenlänge. Wird dieses Licht durch ein Prisma geschickt, so kann man vor dunklem Hintergrund eine mehr oder weniger große Anzahl an scharfen, farbigen Linien entdecken, die für das Element typisch sind. Es ist ein sogenanntes Linienspektrum, genauer gesagt, ein Emissionsspektrum entstanden.
Schickt man weißes Sonnenlicht durch ein Prisma, so kann man ein kontinuierliches Farbspektrum mit den schönen Farbbändern sehen, wie bei einem Regenbogen.
Ein Absorptions-Spektrometer ist ein Gerät, bei dem man zwischen der Lichtquelle und dem Prisma eine zu untersuchende Stoffprobe bringt. Diese Stoffprobe absorbiert einen bestimmten Teil des Lichts, man sieht im Spektrum fehlenden Linien, die charakteristisch für den Stoff ist. Es ist ein Absorptionsspektrum entstanden.
Diese Entdeckung stand damals im Widerspruch zu den Vorstellungen vom kontinuierlichen Lichtspektrum. Eigentlich hätte ein Farbverlauf beobachtet werden müssen, auf keinen Fall scharf abgegrenzte Linien.
Linienspektum eines Wasserstoff-Atoms (oben: Emissionsspektrum, unten: Absorptionsspektrum):
Im Jahre 1885 gelang es BALMER durch mühevolle mathematische Berechnungen eine empirische Formel für die Berechnung der sichtbaren Spektrallinien des Wasserstoffatoms aufzustellen. Sie wurde 1890 von Rydberg in eine praktikable Form gebracht. Dabei stellte sich heraus, das die Energiewerte der Spektrallinien ganzzahlige Vielfache darstellen.
1900 stellte sich MAX PLANCK vor, dass Atome nur Licht eindeutig gegebener Wellenlänge bzw. Frequenz absorbieren und emittieren kann. Er ging davon aus, dass Licht gequantelt sein muss, sich also aus kleinen Energiepaketen zusammensetzt.
Quant (lat. quantum: Menge) sind kleinste, nicht mehr teilbare Werte einer physikalischen Größe (z.B. die Elementarladung und Masse eines Elektrons).
NIELS BOHR nahm 1913 diese Gedanken in seinem Atommodell auf. Es begann die Atomphysik. Die Chemie wurde Teilgebiet der Physik.
1. Postulat
Elektronen dürfen nur auf bestimmten fest definierten Bahnen um den Kern kreisen. Dazwischen können sie nicht existieren.
2. Postulat
Elektronen dürfen auf diesen Bahnen nicht strahlen, da sie die Bahn sonst durch den Energieverlust nicht halten können.
3. Postulat
Elektronen springen unter Abstrahlung von Energie in Form von Licht von einer äußeren zu einer inneren Bahn. Diese Energie ist gequantelt.
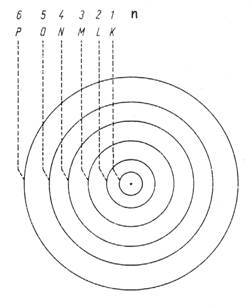
Vereinfachte schematisierte Darstellung des Bohrschen Atommodells:
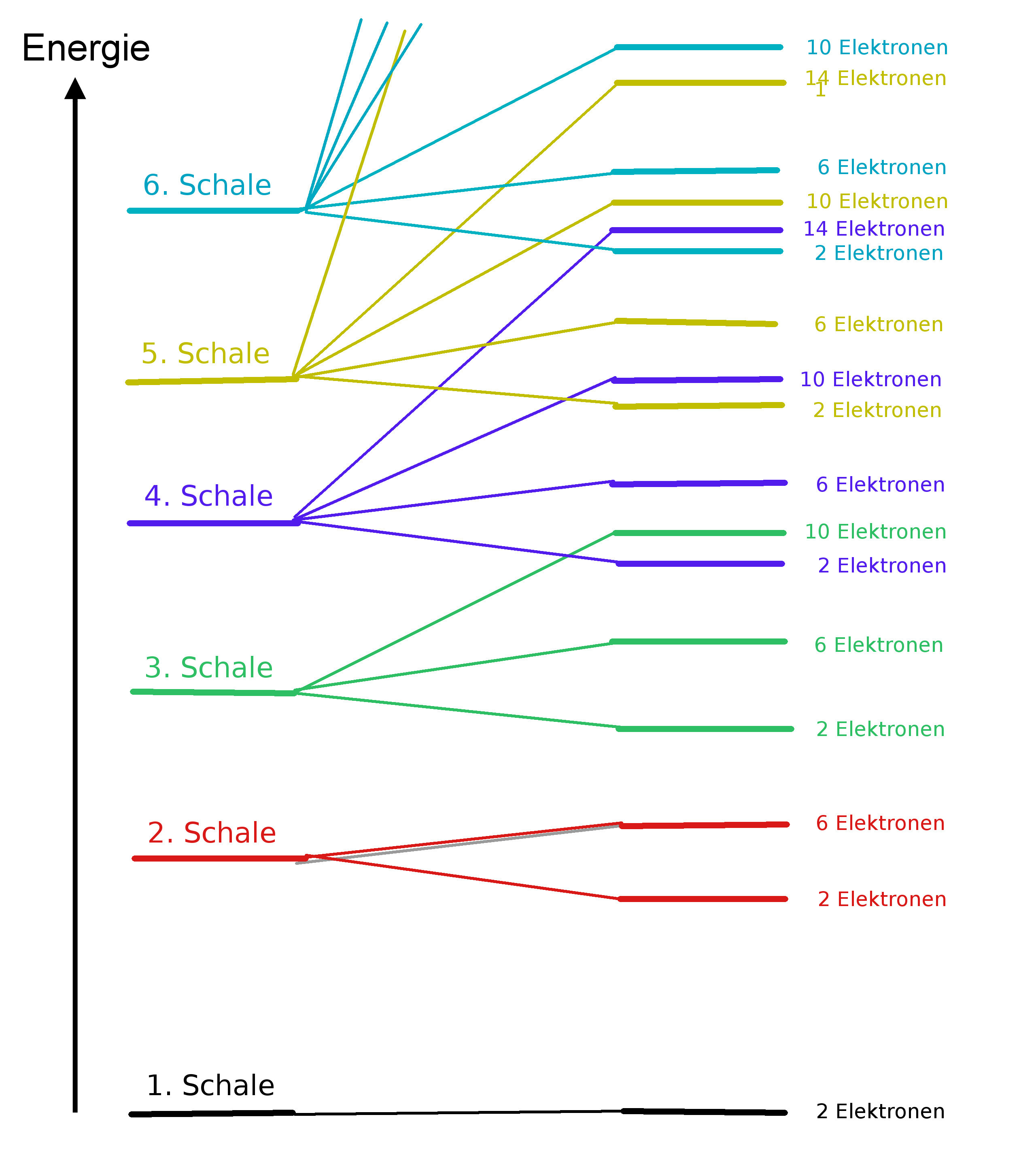
Die Zahlen "n" werden auch Hauptquantenzahlen genannt. Jede Energiestufe kann nur durch eine bestimmte Anzahl von Elektronen besetzt werden. Die maximale Elektronenzahl beträgt jeweils 2n2. Siehe auch hier.
 Je weiter eine Bahn vom Atomkern entfernt ist, desto energiereicher ist sie. Je nach Energieinhalt (Besetzung der Elektronenbahnen) kann ein Atom in mehreren "Zuständen" existieren. Den energetisch niedrigsten Zustand bezeichnet man als "Grundzustand", während die anderen Zustände "angeregte Zustände" genannt werden.
Je weiter eine Bahn vom Atomkern entfernt ist, desto energiereicher ist sie. Je nach Energieinhalt (Besetzung der Elektronenbahnen) kann ein Atom in mehreren "Zuständen" existieren. Den energetisch niedrigsten Zustand bezeichnet man als "Grundzustand", während die anderen Zustände "angeregte Zustände" genannt werden.
Eine Spektrallinie entspricht also der Differenz zweier Atomzustände oder "Terme". Man bezeichnet ein solches Energiestufenschema auch als "Termschema".
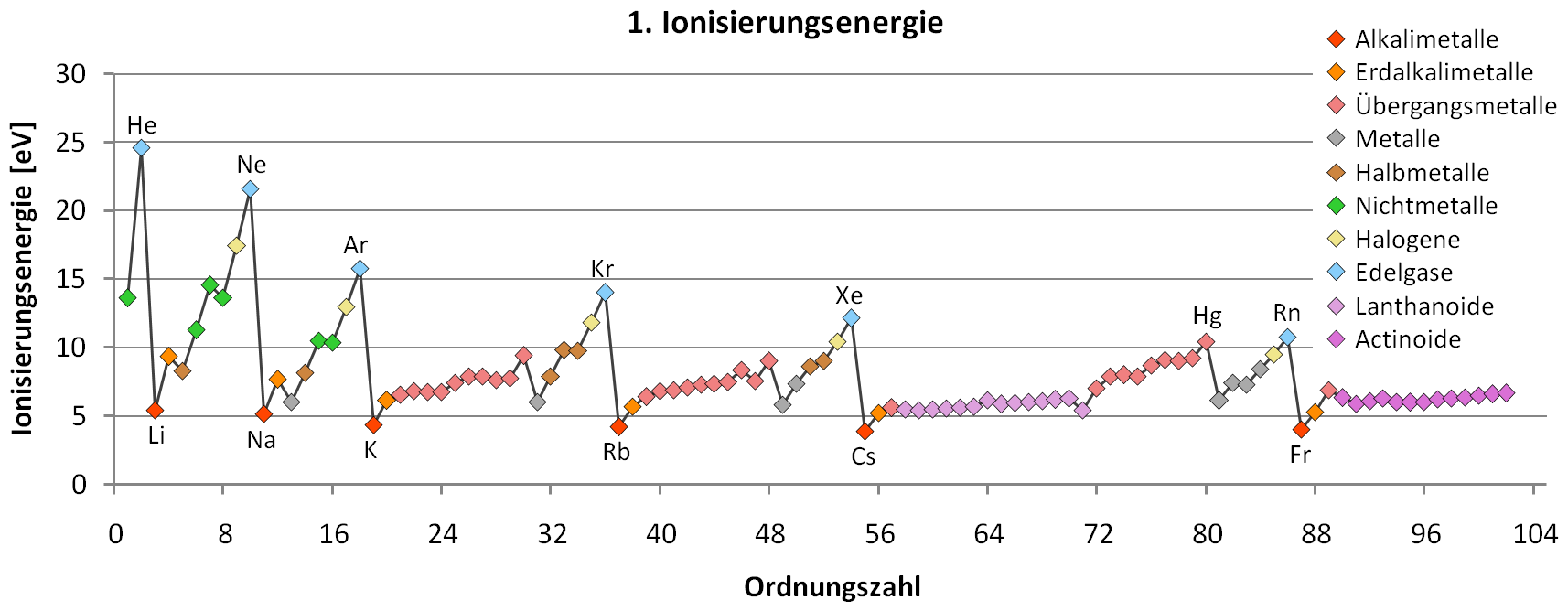
Auch die Ionisierungsenergien oder die Ionen- und Atomradien konnten mit Hilfe des Modells erklärt werden. Der gesamte Aufbau des periodischen Systems der Elemente (PSE) wurde auf die Beschreibung stationärer Elektronenzustände zurückgeführt.
Bohrs Verdienst ist es, die sprunghaften Strahlungsübergänge der Emission und Absorption als Energiedifferenzen zu betrachten, die der Quantenbedingung genügen. Er ist damit einer der Väter der Quantentheorie.
Obwohl Bohr mit der oben angesprochenen Quantisierung schon Züge der Quantenmechanik hatte, stellte er sich die Elektronen als winzige Kügelchen vor, die einen festen Ort und eine feste Geschwindigkeit haben. Dieses Modell stellte sich sehr bald als falsch heraus.
Grenzen des Bohrschen Atommodells ...
 Eines der größten Nachteile des Modells von Bohr ist die Unzulänglichkeit, das Zustandekommen von Bindungen und die Geometrie von Molekülen zu erklären.
Eines der größten Nachteile des Modells von Bohr ist die Unzulänglichkeit, das Zustandekommen von Bindungen und die Geometrie von Molekülen zu erklären.




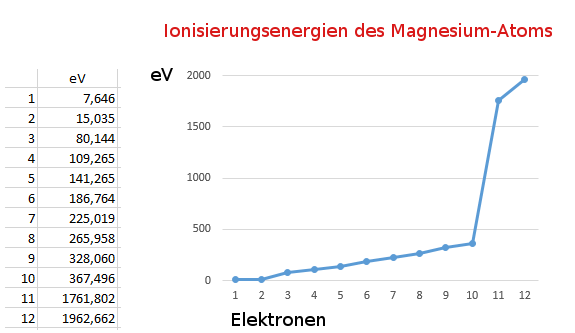
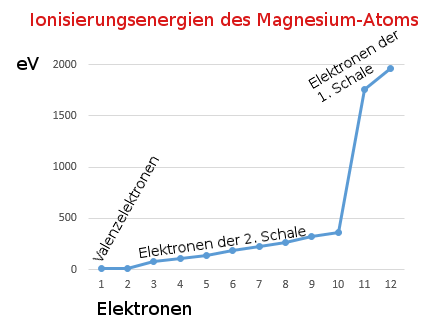 Wenn das erste Elektron vom Atom abgetrennt wird (1. Ionisierungsenergie), bleibt ein Ion zurück. Wegen seiner positiven Ladung zieht es Elektronen besonders stark an. Diese Anziehungskraft muss beim Entfernen eines weiteren Elektrons überwunden werden, was zusätzliche Energie benötigt. Je mehr Elektronen entfernt werden, umso stärker wirkt die positive Ladung des entstehenden Ions, umso stärker wird das nächste Elektron festgehalten.
Wenn das erste Elektron vom Atom abgetrennt wird (1. Ionisierungsenergie), bleibt ein Ion zurück. Wegen seiner positiven Ladung zieht es Elektronen besonders stark an. Diese Anziehungskraft muss beim Entfernen eines weiteren Elektrons überwunden werden, was zusätzliche Energie benötigt. Je mehr Elektronen entfernt werden, umso stärker wirkt die positive Ladung des entstehenden Ions, umso stärker wird das nächste Elektron festgehalten.