Das Schalenmodell (erweitertes Kern-Hülle-Modell)
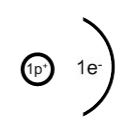
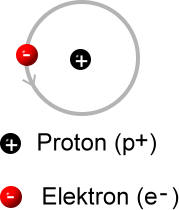
Das Modell von Rutherford wurde von Niels Bohr 1913 erweitert und verfeinert: Demnach bewegen sich negative "Teilchen" (Elektronen) auf bestimmten Bahnen (Schalen) mit extrem großer Geschwindigkeit um den Atomkern, der aus positiv geladenen Protonen und nicht geladenen Neutronen zusammengesetzt ist.
Niels Bohr ging mit seinen Erkenntnissen aber noch weiter. Dazu aber mehr in der Oberstufe. Das an dieser Stelle vorgestellte Schalenmodell ist ein für die Schulchemie vereinfachtes Modell.
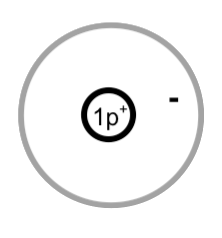
Ein Wasserstoff-Atom
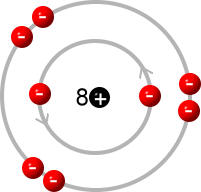
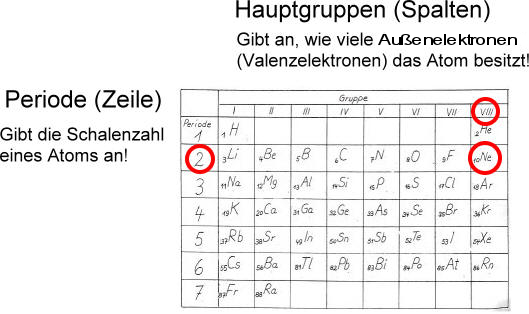
Die Protonenzahl eines Atoms wird auch Kernladungszahl genannt. Alle Elemente sind im Periodensystem der Elemente nach ihrer Kernladungszahl geordnet.
Ein Helium-Atom
[Helium ist ein Edelgas!]
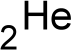
 Mit 2 Elektronen ist diese Schale maximal besetzt. Ist die äußerste Schale maximal, also voll besetzt, so spricht man von der Edelgaskonfiguration, da alle Edelgase diesen Zustand besitzen. Dies ist ein optimaler Zustand für ein Atom. Daher reagieren die Edelgase nur unter extremen Bedingungen.
Mit 2 Elektronen ist diese Schale maximal besetzt. Ist die äußerste Schale maximal, also voll besetzt, so spricht man von der Edelgaskonfiguration, da alle Edelgase diesen Zustand besitzen. Dies ist ein optimaler Zustand für ein Atom. Daher reagieren die Edelgase nur unter extremen Bedingungen.
Ein Lithium-Atom
Die innerste Schale des Lithium-Atoms kann nur zwei Elektronen aufnehmen. Ein Lithium-Atom besitzt eine weitere Schale, auf der sich ein weiteres Elektron bewegt.
Ein Lithium-Atom besitzt in der Regel vier Neutronen. Demzufolge ist die Atommasse eines Lithium-Atoms ca. 7u.
Die Neutronenzahl kann bei einem Element variieren (Isotope). Die Neutronenzahl eines Elementes soll im Folgenden vernachlässigt werden.
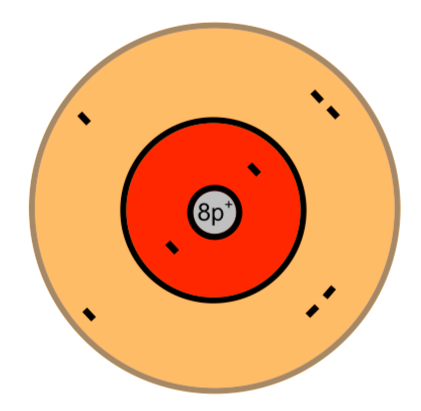
Ein Sauerstoff-Atom
Anmerkung:
Die Elektronen sind hier auf der äußersten Schale als Pärchen dargestellt. Dies nur, damit man sie leichter zählen kann ;)
Die Anzahl der Schalen, die Anzahl der Elektronen auf der äußersten Schale (Valenzschale) und die Anzahl der Protonen und damit auch die Anzahl der gesamten Elektronen des Atoms kann man direkt aus dem Periodensystem der Elemente (PSE) heraus lesen:
Ein Neon-Atom
[Neon ist ein Edelgas!]

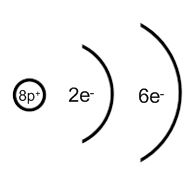
Das nächste Element mit 11 Protonen ist Natrium. Das 11. Elektron befindet sich auf einer dritten Schale.
Wie viele Elektronen können die verschiedenen Schalen maximal aufnehmen?
Beispiel:
Auf der dritten Schale passen maximal 2 · n · n = 2 · 3 · 3 = 18 Elektronen
Das ist zunächst verwirrend. Man lernt doch in der Schule, dass auf der 3. Schale maximal 8 Elektronen Platz finden. So besitzt auch Argon als Edelgas 8 Elektronen auf der äußersten, dritten Schale.
Frage: Wo sollen dann die restlichen 10 Elektronen unterkommen?
Die Antwort ist für registrierte Mitglieder hier sichtbar:

- Besitzt ein Atom eine voll besetzte Schale, so ist das Atom besonders stabil. Die Elemente, die im PSE eine voll besetzte Schale haben, sind die so genannten Edelgase, die auch nur unter extremen Bedingungen mit anderen Stoffen reagieren.
- Die erste Schale ist mit zwei Elektronen voll besetzt.
- Die zweite und dritte Schale ist bei den Hauptgruppenelementen mit acht Elektronen voll besetzt (OktettregelLex).
- Besitzt ein Atom eine voll besetzte Schale, so spricht man auch von der so genannten "EdelgaskonfigurationLex".
- Die Atome eines Elementes sind oft nicht völlig identisch. Sie können sich in der Neutronenanzahl unterscheiden. Solche Atome nennt man Isotope. Die Isotope unterscheiden sich dadurch in der Masse. Im PSE wird der Durchschnittswert der Masse angegeben. Daher gibt es Elemente mit einer Atommasse, die nicht ein ganzzahliges Vielfache von 1 u ist.
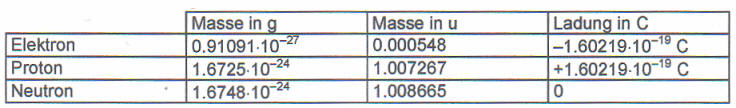
- "Die Elementarteilchen" im Überblick (vereinfacht):
Elementarteilchen Masse in unit [u] Ladung in Coulomb [C] Elektron sehr gering -1 Proton 1 +1 Neutron 1 keine
Grenzen des Modells
Es gibt drei große Unstimmigkeiten beim Schalenmodell:
- Da sich positiv und negativ geladene Teilchen anziehen, müssten die negativ geladenen Elektronen in den positiv geladenen Kern stürzen. Auch dann, wenn man annimmt, dass die Zentrifugalkraft der Elektronen gleich der Anziehungskraft des Kernes ist. Die Elektronen müssten nämlich bei ihren Umrundungen Energie verlieren.
- Die positiv geladenen Protonen im Kern liegen alle dicht beieinander. Wieso stoßen sie sich nicht gegenseitig ab. Ein recht schwacher Erklärungsversuch ist die Annahme, dass die Neutronen die Abstoßung verhindern, also sozusagen als Klebstoff wirken.
- Die Masse eines Elektrons ist (im Verhältnis zum Proton oder Neutron) so extrem gering, dass man sich fragen muss, ob man überhaupt noch von einem Teilchen sprechen kann.
Es gibt noch mehr, dass sich mit dem Schalenmodell nicht erklären lässt ...