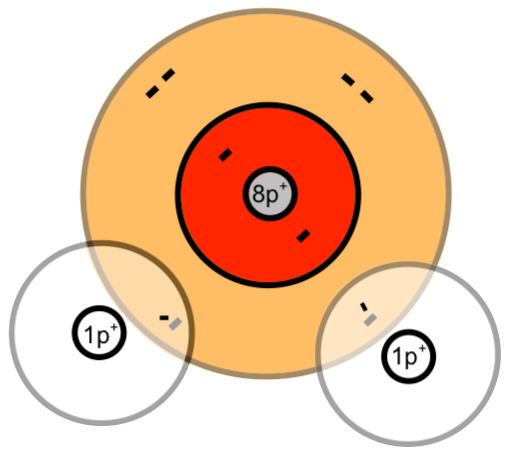
Bildung von Molekülen nach dem Schalenmodell bzw. nach dem Kugelschalenmodell
Alle Atome sind bestrebt, eine voll besetzte Schale zu bekommen, die sogenannte Edelgaskonfiguration. Alle Edelgase besitzen eine mit Elektronen voll besetzte äußerste Schale. Das ist offensichtlich ein sehr stabiler Zustand für Atome. Und genau hier liegt der Grund, warum und wie sich Atome miteinander binden. Alle Atome versuchen eine Edelgaskonfiguration zu erhalten. Prinzipiell gibt es für das Erlangen einer voll besetzten Schale verschiedene Möglichkeiten:
- Das Atom nimmt von einem anderen Atom Elektronen auf oder gibt welche ab. In beiden Fällen entstehen geladene Teilchen (Ionen), mit denen wir uns aber erst im Kapitel "Salze" beschäftigen werden.
- Außenelektronen werden von mehreren Atomen gemeinsam benutzt. Genau diesen Fall werden wir uns nun näher anschauen:
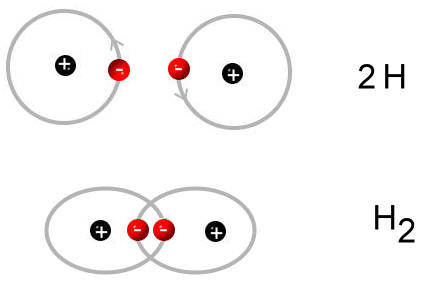
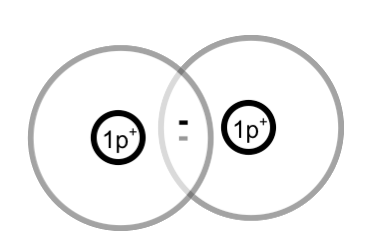
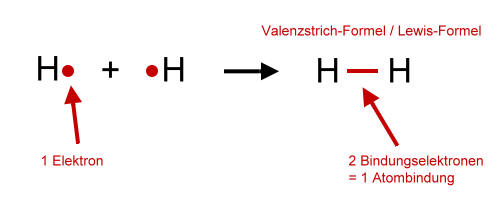
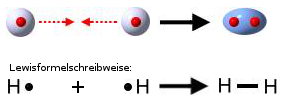
Wenn zwei Wasserstoff-Atome gemeinsam ihre Elektronen benutzen, stehen jedem Wasserstoff-Atom zwei Elektronen zur Verfügung. Mehr Elektronen könnte ein Wasserstoff-Atom auch nicht benutzen, da auf der ersten Schale, die "relativ" dicht am Kern ist, nur zwei Elektronen Platz finden.
Zwei einzelne Wasserstoff-Atome bilden ein Wasserstoff-Molekül:
| Schalenmodell | Kugelschalenmodell |
 |
 H2 H2 |

Elektronen, die gemeinsam benutzt werden, heißen Bindungselektronen. Diese Bindungselektronen bilden die Atombindung zwischen den Atomen. Andere Bezeichnungen für die Atombindung sind: Elektronenpaarbindung und kovalente Bindung.
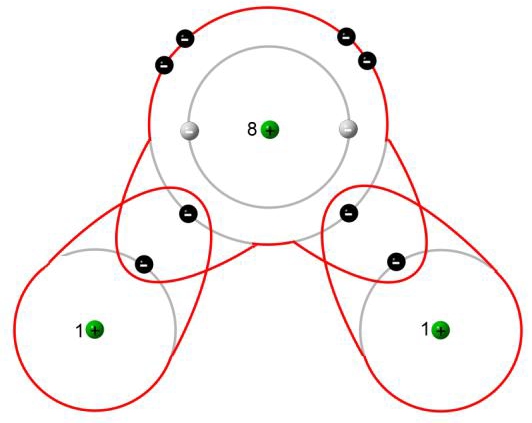
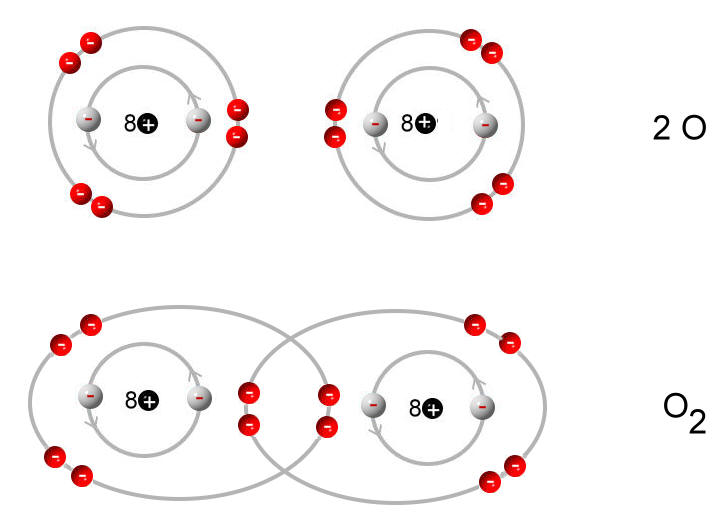
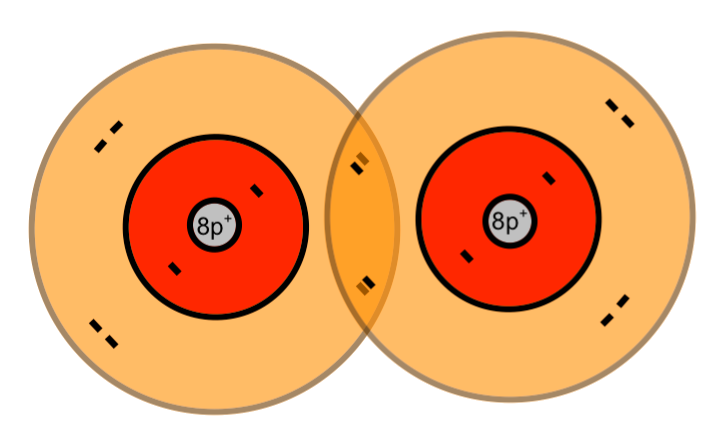
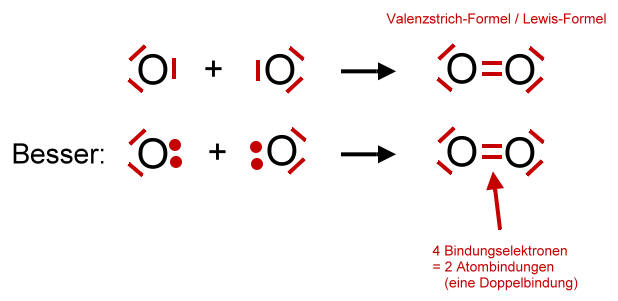
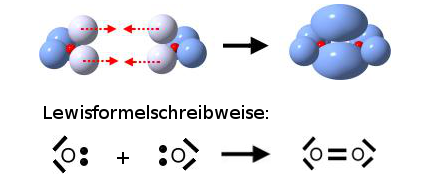
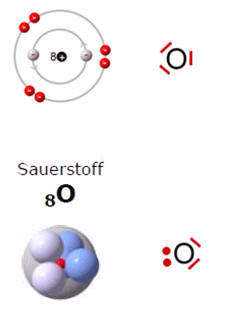
Zwei einzelnde Sauerstoff-Atome bilden ein Sauerstoff-Molekül:
| Schalenmodell | Kugelschalenmodell |
 |
 O2 O2 |
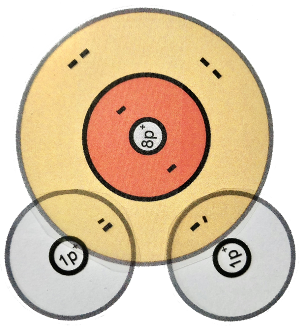
Das Sauerstoff-Atom besitzt zwei Schalen. Nur die äußerste Schale (Valenzschale) spielt bei chemischen Reaktionen eine Rolle.
Jedes Sauerstoff-Atom versucht durch gemeinsame Benutzung der äußeren Elektronen (Valenzelektronen) eine voll besetzte Außenschale (Edelgaskonfiguration) zu erhalten.
Wenn zwei Sauerstoff-Atome je zwei Elektronen des anderen mit benutzen, dann stehen jedem Sauerstoff-Atom acht Außenelektronen zur Verfügung. Auf die zweite (und dritte) Schale eines Atoms eines Hauptgruppenelementes haben bis zu acht Elektronen Platz (Oktettregel). Durch gemeinsame Benutzung von Elektronen erhalten beide Sauerstoff-Atome die Edelgaskonfiguration.
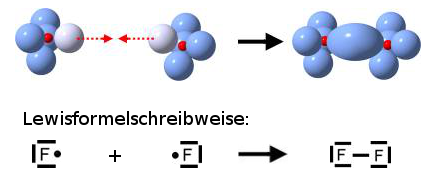
Anmerkung:
Beim Schalenmodell wurden die inneren Elektronen grau gezeichnet, weil sich bei einer chemischen Reaktion auf den inneren Schalen nichts verändert.






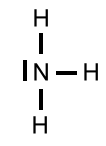

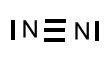
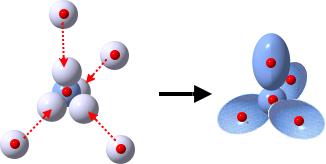


 Nun sind in unserem Beispiel 6 (3 Elektronenpaare) von den 8 Valenzelektronen in der Formel für die 3 Bindungen verbaut worden. Es gibt also noch 1 nicht bindendes Elektronenpaar.
Nun sind in unserem Beispiel 6 (3 Elektronenpaare) von den 8 Valenzelektronen in der Formel für die 3 Bindungen verbaut worden. Es gibt also noch 1 nicht bindendes Elektronenpaar.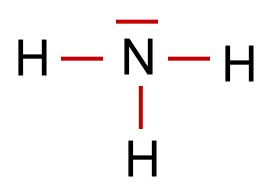
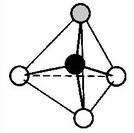
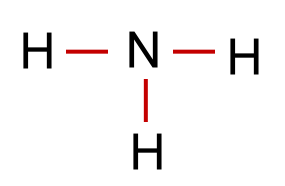
 Aus diesen Überlegungen ergibt sich für das Ammoniak-Molekül ein Tetraeder, der jedoch wegen der Regel 2 einen Bindungswinkel(H-N-H) von 107,0° statt des Tetraederwinkels von 109,5° hat.
Aus diesen Überlegungen ergibt sich für das Ammoniak-Molekül ein Tetraeder, der jedoch wegen der Regel 2 einen Bindungswinkel(H-N-H) von 107,0° statt des Tetraederwinkels von 109,5° hat. Um die räumliche
Um die räumliche