Du bist dir nicht sicher, ob du das wirklich verstanden hast? Hier noch einmal ausführlicher ...
Du bist dir nicht sicher, ob du das wirklich verstanden hast? Hier noch einmal ausführlicher ...
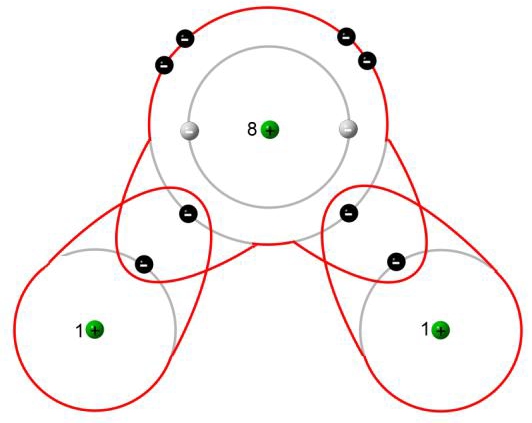
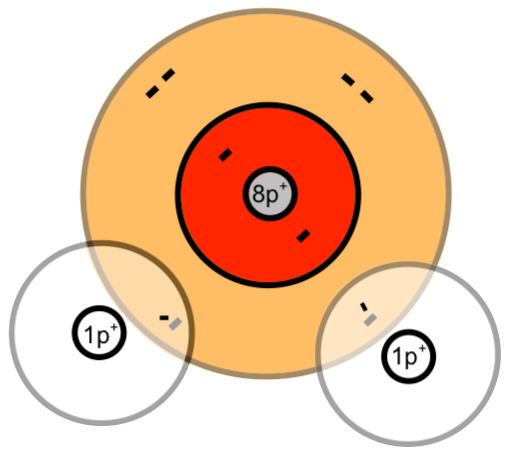
Ein Sauerstoff-Atom besitzt sechs Valenzelektronen. Als Nichtmetall-Atom hat ein Sauerstoff-Atom schon recht viele Valenzelektronen auf der Valenzschale. Sein Bestreben ist es, die Valenzschale zur Edelgaskonfiguration aufzufüllen. Dazu benötigt das Sauerstoff-Atom noch zwei Elektronen. Damit hätte es acht. Elemente der Periode 2 und 3 versuchen acht Elektronen auf deren Valenzschalen zu bekommen (Oktettregel). Mit einer voll besetzten Valenzschale wäre Sauerstoff chemisch stabil. Dies ist der Zustand, der von einem Sauerstoff-Atom angestrebt wird. Um dies zu erreichen, kann ein Sauerstoff-Atom zwei Elektronen von jeweils einem Wasserstoff-Atom benutzen. Zähle die schwarz gezeichneten Elektronen: Es sind acht für das Sauerstoff-Atom.
Auf der anderen Seite haben wir die zwei Wasserstoff-Atome, die jeweils nur ein Elektron besitzen. Die erste Schale eines Atoms kann maximal zwei Elektronen aufnehmen. Also benötigt jedes Wasserstoff-Atom noch ein weiteres Elektron. Daher benutzt jedes Wasserstoff-Atom noch ein Elektron des Sauerstoff-Atoms mit.
Alle Atome haben also durch gemeinsame Benutzung von Valenzelektronen eine voll besetzte Schale erhalten und damit die Edelgaskonfiguration erlangt.
Falls du das immer noch nicht richtig verstanden hast, empfehle ich dir dringend noch einmal das Kapitel "Ein neues Atommodell muss her" von vorne durchzuarbeiten.