Damit du ein Reaktionsschema in Symbolformelschreibweise aufstellen kannst, solltest du dir noch einmal folgende Themen anschauen:
Eine Anleitung
Ein Reaktionsschema in Symbolformelschreibweise stellt man in vier Schritten auf. Dies soll an einem Beispiel verdeutlicht werden:
Aufgabe: Stelle das Reaktionsschema in Symbolformelschreibweise für die Synthese von Aluminiumoxid auf!
1. Formel des Reaktionsproduktes
Im Namen Aluminiumoxid ist keine Wertigkeit angegeben. Das bedeutet: Es gibt nur eine Wertigkeit des Aluminiums. Aluminium steht im PSE in der III. Hauptgruppe (Spalte), also ist Aluminium dreiwertig.

Das bedeutet, die kleinste Baueinheit dieser Verbindung besteht aus zwei Aluminium-Atomen und drei Sauerstoff-Atomen.
2. Schlussfolgern, welche Ausgangsstoffe (Edukte) benötigt werden
Welche Stoffe benötige ich, um Aluminiumoxid herzustellen? Dazu muss das Wortreaktionsschema aufgestellt werden.

3. Symbole bzw. Formeln der Stoffe ergänzen
Nun werden die Symbole vervollständigt:

Denke daran: Die Elemente Wasserstoff, Sauerstoff und Stickstoff kommen molekular vor! Später lernst du noch, dass auch die Halogene molekular vorkommen.
4. Das "Ausgleichen"
Die Anzahl der Atome muss auf beiden Seiten des Reaktionsschemas gleich sein.
Vorgehensweise: Suche zunächst die größte arabische (1,2,3 ...) Zahl und schaue, welche Atomart direkt davor steht. Mit dieser Atomart fängst du an. Wenn es mehrere Möglichkeiten gibt, dann nimm den Sauerstoff. In unserem Beispiel sind es die Sauerstoff-Atome im Aluminiumoxid. Die Baueinheit Aluminiumoxid besitzt drei Sauerstoff-Atome. Jetzt zähle die Sauerstoff-Atome auf der linken Seite der Gleichung (Ausgangsstoffe, Edukte): Es sind zwei. Das kleinste gemeinsame Vielfache von drei und zwei ist sechs. Also müssen sechs Sauerstoff-Atome auf der linken und sechs Sauerstoff-Atome auf der rechten Seite sein. Entsprechend muss ich die Sauerstoffmoleküle mit dem Faktor drei multiplizieren und Aluminiumoxid mit dem Faktor zwei.
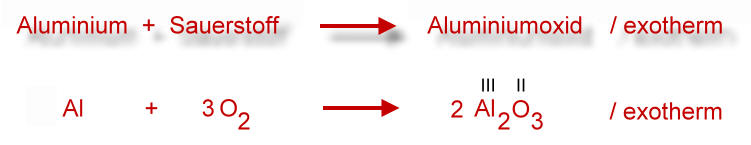
Doch etwas stimmt hier noch nicht, nämlich die Anzahl der Aluminiumteilchen. Deshalb:

So, geschafft!




 Nötige Vorkenntnisse - Links
Nötige Vorkenntnisse - Links Lernziele / Kompetenzen - Links
Lernziele / Kompetenzen - Links
 Anknüpfungen - Links
Anknüpfungen - Links