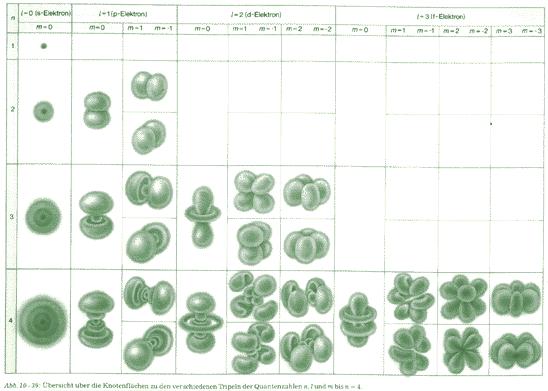
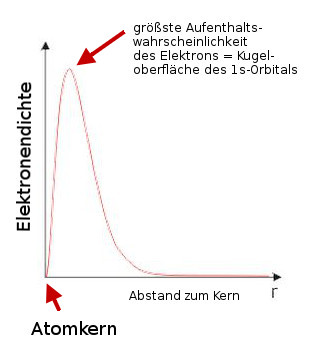
Was kann die Orbitaltheorie gegenüber des Atommodells von Bohrs leisten?
An dieser Stelle soll ein Überblick zeigen, welche Phänomene mit Hilfe des Orbitalmodells erklärt bzw. gedeutet werden können, die mit dem Atommodell von Bohr nicht zu klären waren. Es ist aber auch wichtig zu verstehen, dass für andere Fragestellungen durchaus das Atommodell von Bohr von großem Nutzen ist, gerade wegen seiner Einfachheit.
- Die gemeinsame Benutzung von Elektronen für das Zustandekommen von Atombindungen ist durch eine Überlappung/Verschmelzung von Orbitalen einsichtiger, als wenn man sich vorstellen muss, dass Elektronen gemeinsam benutzt werden, die sich mit einer wahnsinnig hohen Geschwindigkeit bewegen.
- Molekülgeometrien und Bindungswinkel lassen sich mit dem Orbitalmodell besser abbilden als mit dem Modell von Bohr. Die Molekülgeometrie spielt besonders in der Biochemie eine außerordentlich große Rolle.
- Mit Hilfe der Orbitaltheorie lassen sich energetische Betrachtungen im Molekül ableiten.
- Mit Hilfe des Orbitalmodells lassen sich bestimmte Unregelmäßigkeiten im PSE erklären, die mit dem Bohrschen Atommodell nicht zu erklären sind (z.B. 1. Ionisierungsenergien oder warum bei den Übergangsmetallen der 4. Periode noch weiter Elektronen auf der 3. "Schale" Platz finden).
- Die Reaktivität von Doppelbindungen lassen sich mit Hilfe des Orbitalmodells besser erklären.
- Erst durch die Orbitaltheorie konnte man sich eine Vorstellung von delokalisierten Elektronen machen, die z.B. für die Farbigkeit von Stoffen verantwortlich gemacht werden können.



 Pauli formulierte 1925 das nach ihm benannte
Pauli formulierte 1925 das nach ihm benannte