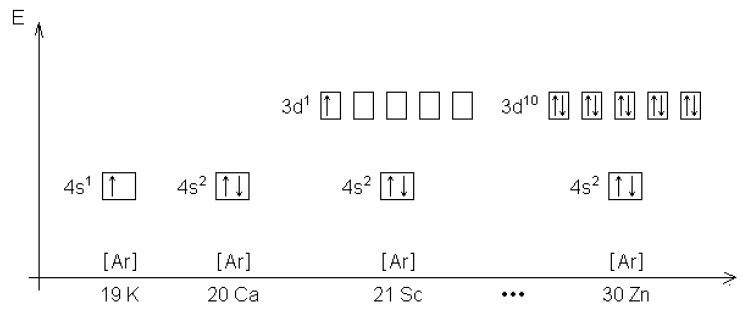
Kästchenschreibweise
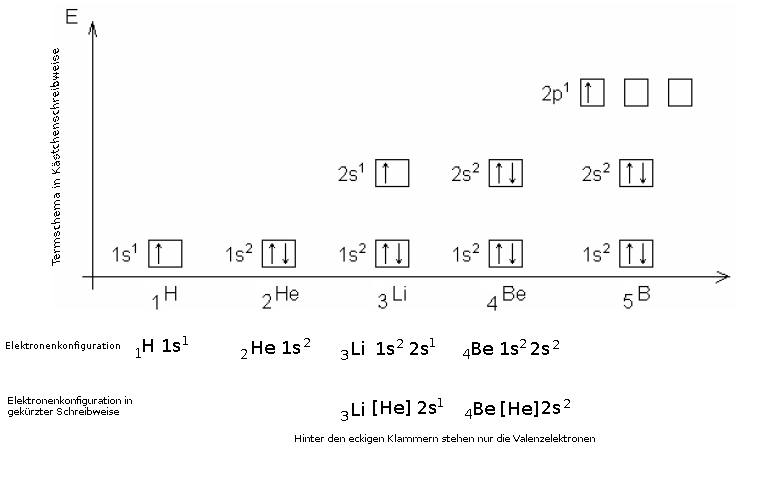
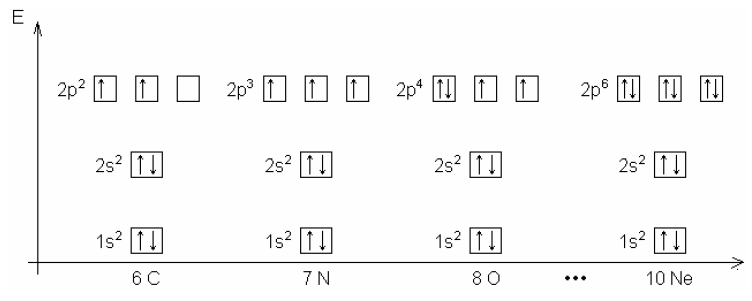
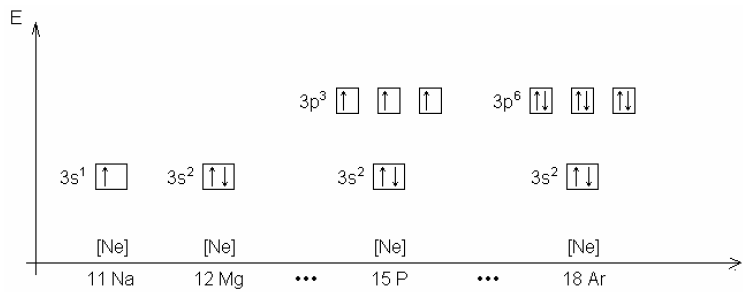
Ein Orbital wird durch ein Kästchen dargestellt. Die Anzahl der in ihm vorhandenen Elektronen wird durch eine kleine hochgestellte Zahl bzw. durch Pfeile verdeutlicht.
Für die Besetzung der Orbitale mit Elektronen sind drei Prinzipien maßgebend:
- Pauli Prinzip: In jedem Orbital finden maximal zwei Elektronen Platz, wobei sich die beiden Elektronen in der Spinquantenzahl unterscheiden. Dies wird mit der unterschiedlichen Ausrichtung der Pfeile verdeutlicht.
- Hund´sche Regel: Energetisch gleichwertige Orbitale werden erst gleichmäßig einfach besetzt, bevor sie doppelt besetzt werden.
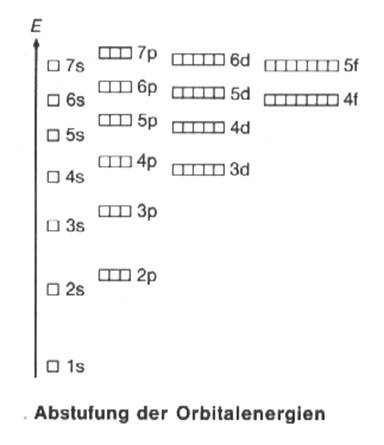
- Aufbauprinzip: Die Orbitale werden in der Reihenfolge steigender Energie aufgefüllt (siehe nächste Abbildung).
Kommentar schreiben