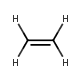
Die Doppelbindung am Beispiel von Ethen
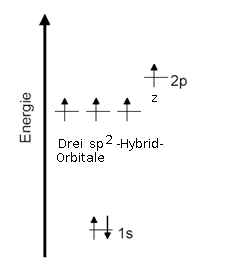
 Wenn zwei Kohlenstoff-Atom eine Doppelbindung eingehen wollen, so müssen die beiden Kohlenstoff-Atome jeweils ein p-Orbital besitzen. Dies ist bei der sp2-Hybridisierung der Fall:
Wenn zwei Kohlenstoff-Atom eine Doppelbindung eingehen wollen, so müssen die beiden Kohlenstoff-Atome jeweils ein p-Orbital besitzen. Dies ist bei der sp2-Hybridisierung der Fall:
Vergleiche auch: Elektronenkonfiguration des Kohlenstoff-Atoms im Überblick.
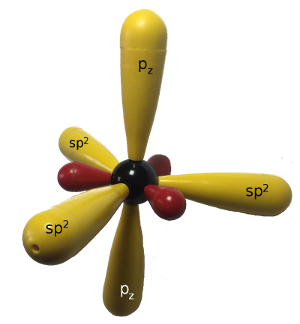
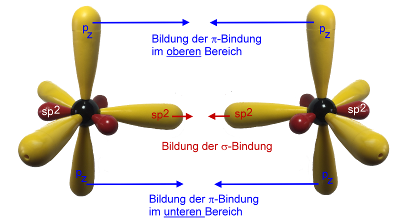
Wenn sich nun die beiden sp2-hybridisierten Kohlenstoff-Atome binden, dann wird zum einen eine sp2-sp2-σ-Bindung gebildet, wie wir es in den vorigen Fällen schon gesehen haben, zum anderen überlappen sich alle vier Lappen der beiden p-Orbitale:
 Die Überlappung von p-Orbitalen liefert eine Bindung, die nicht mehr rotationssymmetrisch und auch nicht mehr drehbar ist. Solche Bindungen nennt man π-Bindungen.
Die Überlappung von p-Orbitalen liefert eine Bindung, die nicht mehr rotationssymmetrisch und auch nicht mehr drehbar ist. Solche Bindungen nennt man π-Bindungen.
Eine Doppelbindung besteht aus einer π-Bindung und einer σ-Bindung.
Beim Ethen-Molekül liegen also folgenden Bindungen vor:
- Fünf σ-Bindungen:
Vier σ-Bindungen zwischen einem Kohlenstoff- und einem Wasserstoff-Atom (s-sp2-σ-Bindungen).
Eine σ-Bindung zwischen den beiden Kohlenstoff-Atomen (sp2-sp2-σ-Bindung).
- Eine π-Bindung zwischen den beiden Kohlenstoff-Atomen (p-p-π-Bindung).
Die π-Bindung bildet sich nach folgendem Schema:
Aufgrund der nicht mehr freien Drehbarkeit der Doppelbindung ergibt sich für das Ethen-Molekül eine planare Geometrie mit einem Bindungswinkel von 120°.
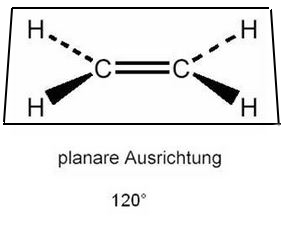
Gestrichelte Linien: Die Wasserstoff-Atome sind in Bezug zur Papierebene nach hinten ausgerichtet.
Keile: Die Wasserstoff-Atome sind in Bezug zur Papierebene nach vorne ausgerichtet.