Das Methan-Molekül
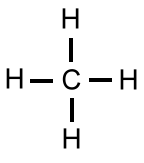
Wie wir im Artikel "Elektronenkonfiguration des Kohlenstoff-Atoms im Überblick" gesehen haben, kann ein Kohlenstoff-Atom vier identische sp3-Hybrid-Orbitale bilden. Damit kann ein Kohlenstoff-Atom vier Einfachbindungen mit jeweils einem Wasserstoffatom ausbilden, welches ja auch nur ein halb besetztes Orbital besitzt:
Aus einem s-Orbital (eines Wasserstoff-Atoms, hier weiße Kugel) und einem Lappen eines sp3-Hybrid-Orbitals eines Kohlenstoff-Atoms entsteht durch Überlappung eine Bindung, die s-sp3-σ-Bindung genannt wird. Sie ensteht nach folgendem Schema:
 Da alle Bindungen den größt möglichsten Abstand zueinander einnehmen, ergibt sich eine tetraedrische Anordung mit einem Bindungswinkel von 109,5°.
Da alle Bindungen den größt möglichsten Abstand zueinander einnehmen, ergibt sich eine tetraedrische Anordung mit einem Bindungswinkel von 109,5°.
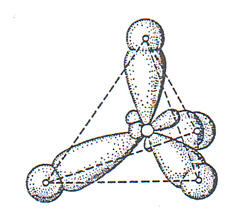
Projektion des Modells auf eine Ebene:






