Struktur und Eigenschaften
Als Wolle werden in erster Linie die Haarfasern des Schafs bezeichnet. Die Bezeichnung Schurwolle soll ausdrücken, dass die Wolle beim lebenden Schaf geschoren wurde. Wolle ist das älteste Fasermaterial.
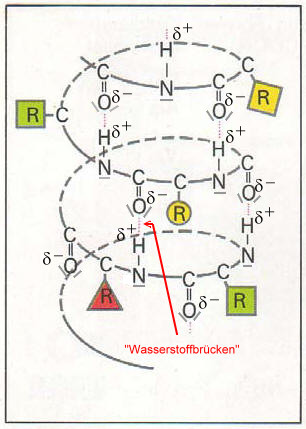
Die "Wasserstoffbrücken" sind vor allem für die Biegsamkeit von Haaren bzw. Wollfasern verantwortlich. Die polare Carbonyl-Gruppe und die polare Amino-Gruppe sind in der Lage Wassermoleküle zu binden, da Wasser selbst ein Dipol ist. Polypeptid-Ketten sind also hygroskopisch. Ein Wollpullover mit einem Gewicht von 1kg kann bis zu 0,3 Liter Luftfeuchtigkeit und Schweiß aufnehmen, ohne dass er sich feucht oder klamm anfühlt. Auch verliert er dabei nicht seine wärmende Wirkung. Die wärmeisolierende Eigenschaft und das Wasseraufnahmevermögen von Wolle ist insbesondere auf die Hohlräume im Faserinneren zurückzuführen.
Wenn sich Wassermoleküle um diese funktionellen Gruppen lagern, sind die intramolekularen Wechselwirkungen nicht mehr wirksam, so dass sich feuchte Wolle, im Gegensatz zu anderen Fasern, bis auf die doppelte Länge dehnen lässt.
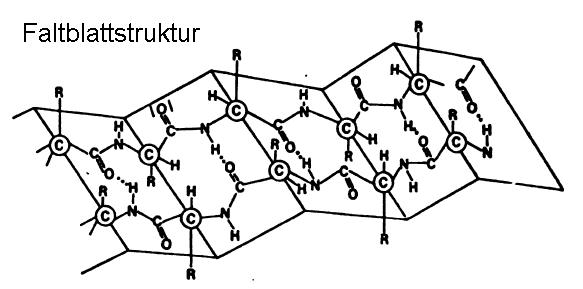
Beim Dehnen von feuchter Wolle geht die Helixstruktur unter Aufbrechen der intramolekularen "Wasserstoff-Brücken" in die Faltblatt-Struktur über. Dabei werden intermolekulare "Wasserstoff-Brücken" zwischen benachbarten Polypeptid-Ketten gebildet:
Bei der Faltblatt-Struktur liegen sich gleichsinnig geladene Aminosäure-Reste gegenüber: die Faltblattstruktur der Wolle ist nicht stabil. Nach der Dehnung geht die Wolle wieder von selbst in die energieärmere Helix-Struktur über.

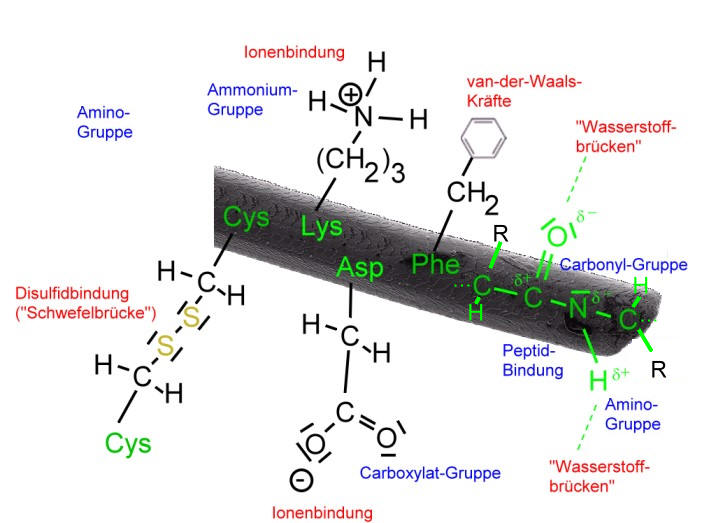
Je nachdem, wie die Aminosäure-Reste beschaffen sind, können bei der Helix zusätzliche Bindungen wie Ionenbindungen ("Salzbrücken") oder kovalente Bindungen ("Schwefelbrücken") für die Stabilität der Helix sorgen. Auch große, unpolare Aminosäure-Reste, mit ihren van-der-Waals-Kräften spielen hierbei eine Rolle.
Die folgende Abbildung ist stark vereinfacht und soll eine Polypeptidkette der Wolle mit verschiedenen Aminosäure-Resten darstellen:
Je nach Lage und Abstand der Seitenketten wirken die Bindungen und Anziehungskräfte nicht nur innerhalb der Helix (intramolekular), sondern auch zwischen benachbarter Helices. Da solche Bindungen oder Anziehungskräfte zwischen verschiedenen Molekülen wirken, spricht man in diesem Fall auch von einer intermolekularen Wechselwirkung . Vor allem die Disulfidbindungen verknüpfen benachbarte Polypeptide.
Da Wolle einen hohen Anteil an der Aminosäure Cystein besitzt, können viele "Schwefelbrücken" ("Cystinbrücken", Disulfidbindung) gebildet werden, welche maßgeblich für die Elastizität und Reißfestigkeit der Wollfaser verantwortlich sind. Bedenke: Bei diesen Schwefelbrücken handelt es sich um kovalente Bindungen.
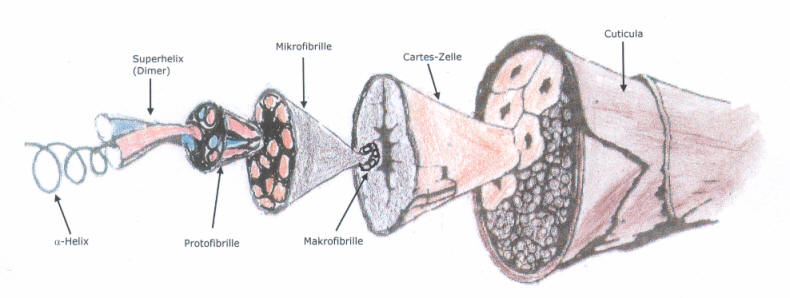
Modell einer Wollfaser
Die Wollfaser besitzt eine Schuppendecke (Cuticula), die an den Stamm einer Palme erinnert und die für flüssiges Wasser undurchlässig ist. Wasserdampf (einzelne Wassermoleküle) gelangt hindurch, die Faser kann also Luftfeuchtigkeit absorbieren (aufnehmen).
Die Schuppendecke besteht aus Fett oder fettähnlichen Substanzen, die einen sehr hohen Vernetzungsgrad besitzen. Dies erklärt auch die mechanische Zähigkeit und die hohe Beständigkeit gegenüber chemischen Stoffen.
Beim Dehnen einer Wollfaser gleiten die Schuppen auseinander. Zieht sich die Faser wieder zusammen, so schieben sich die Schuppen ineinander.
| Eigenschaft | Strukturelle Verantwortlichkeit für diese Eigenschaft |
|
Recht geringe Reißfestigkeit im Vergleich zu anderen Fasern wie z.B. Seide.
|
Beim Überdehnen reißt eine Wollfaser, da kovalente Bindungen ("Schwefelbrücken") in Reißrichtung gebrochen werden und nicht neu aufgebaut werden können.
|
|
Dehnbarkeit und Elastizität:
Bei Zugbeanspruchung dehnt sich Wolle bis zu 30%, ohne zu reißen. Danach zieht sie sich wieder auf ihre ursprüngliche Länge zusammen. Wolle ist aber so gut wie knitterfrei, schmiegsam und weich.
|
Beim Dehnen, also bei Zugbeanspruchung, erfolgt ein Übergang von der Helixstruktur in die energetisch ungünstigere Faltblattstruktur. Dabei wirken die kovalenten Bindungen der "Schwefelbrücken" dem Zerreißen entgegen. Die Schuppen der Cuticula gleiten beim Dehnen auseinander.
Zieht sich die Faser wieder zusammen, so schieben sich die Schuppen ineinander und die Polypeptid-Ketten gehen wieder in die energetisch günstigere Helixstruktur über.
Feuchte Wolle ist schwerer als leichte Wolle, da eine beträchtliche Menge an Wasser durch die Ausbildung von "Wasserstoffbrücken" gebunden wird. Allerdings werden dabei auch die vorher existierenden "Wasserstoffbrücken" zwischen den Carbonyl- und den Amino-Gruppen gebrochen, was zum Ausleiern führt.
|
|
Biegsamkeit.
|
Intramolekulare "Wasserstoffbrücken". |
|
Gutes Isolationsverhalten.
|
Aufgrund der Helixstruktur gibt es viele Hohlräume. Die Luft in den Hohlräumen wird von der eigenen Körperwärme erwärmt. |
| Aufnahme und Abgabe von Wasserdampf (Luftfeuchtigkeit) ohne sich feucht oder klamm anzufühlen (guter Feuchtigkeitstransport). Daher gut für Spezial-Sportbekleidung. Aufnahme von Wasser bis zu 33% des Eigengewichts. |
Hygroskopische Polypeptid-Ketten. Die polaren Carbonyl- und Amino-Gruppen können Wassermoleküle über "Wasserstoffbrücken" binden, also speichern, ohne dass dieses Wasser an die Haut kommt. Da die Wassermoleküle nur durch die "Wasserstoffbrücken" festgehalten werden, können diese Wassermoleküle auch wieder (bei Erwärmung) gut abgegeben werden. |
| Wasserabweisend |
Der sogenannte Mantel bzw. die Schuppendecke (Cuticula) einer Wollfaser besteht aus drei Schichten, wobei die äußerste Schicht aus Lipiden besteht und somit hydrophob ist. Wassertropfen perlen also ab. Wasserdampf (einzelne Wassermoleküle) hingegen kann durch die Cuticula hindurch gelangen. |
| Unempfindlichkeit gegenüber vielen chemischen Stoffen. | Grund ist die lipide Cuticula mit dem hohen Vernetzungsgrad. |
| Formverlust beim Waschen in heißem Wasser. |
Spaltung der stabilisierenden "Schwefelbrücken"; irreversible Strukturschädigung. |
| Formveränderungen beim Waschen mit Seifen, besonders mit Kernseife. Verfilzen |
Beim mechanischen Vorgang des Waschens laden sich einige Seitengruppen auf, es kommt zu elektrostatischen Aufladungen. Dadurch erfolgt ein Aufquellen der Faser. |
| Verhalten gegenüber trockener Hitze (Bügeln bei zu hohen Temperaturen) | Wollfasern können Temperaturen bis ca. 150°C unbeschadet überstehen. Bei hoher Temperatur (250°C) jedoch werden "Wasserstoffbrücken" und "Schwefelbrücken" gebrochen. |