Svante August Arrhenius
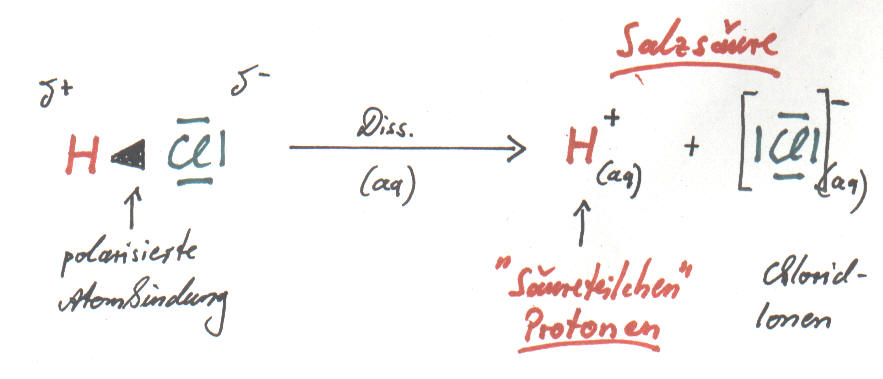
Arrhenius entdeckte, dass sich bestimmte Verbindungen in zwei oder mehrere Moleküle, Atome oder Ionen mit Hilfe eines polaren Lösemittels wie Wasser zerlegen lassen. Eine solche Zerlegung nennt man elektrolytische Dissoziation. In der Regel entstehen zwei Arten von Teilchen: Die Anionen (negativ geladene Ionen) und die Kationen (positiv geladene Ionen). Da Lösungen, die Ionen enthalten, den elektrischen Strom leiten, spricht man auch von einem Elektrolyt.
Für die Theorie der elektrolytischen Dissoziation erhielt Arrhenius 1903 den Nobelpreis für Chemie.

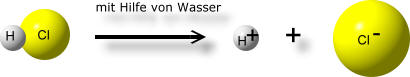
Bezogen auf unser letztes Thema, Chlorwasserstoff und Elektronegativität, lässt sich der Vorgang, wie aus Chlorwasserstoff Salzsäure entsteht, nun besser deuten.