Elektronegativität am Beispiel des Chlorwasserstoffs
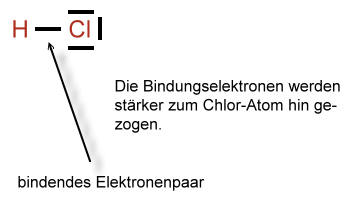
Unterschiedliche Atomsorten (Elemente) ziehen unterschiedlich stark an Bindungselektronen. Allgemein kann man sagen, dass Elemente, die weiter rechts im PSE stehen auch stärker ziehen.

Elektronegativität bezeichnet die Fähigkeit eines Atoms die Bindungselektronen an sich zu ziehen.
Da Elektronen negative Teilchen sind, findet auch eine Ladungsverschiebung statt.
Da ein Elektron zum Chlor-Atom hin gezogen wird, erhält das Chlor-Atom eine negative Teilladung (Partialladung, partielle Ladung). Symbol hierfür ist der kleine griechische Buchstabe "d":
δ- (gesprochen: Delta Minus)
Dem Wasserstoff-Atom wird das einzige Elektron etwas entzogen: Die positive Ladung des Kerns (Ein Wasserstoff-Atom besitzt nur ein Proton) überwiegt. Es besitzt eine partielle positive Ladung.
δ+ (gesprochen: Delta Plus)
Die ungleichmäßige Verteilung der Bindungs-Elektronen bezeichnet man als polare Atombindung.
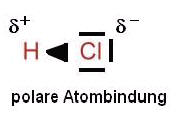
Die polare Atombindung kommt also durch die Elektronegativitäts-Differenz (ΔEN) der beteiligten Atom-Sorten zustande.
Die folgende Tabelle zeigt die Elektronegativitätswerte der Hauptgruppenelemente nach Pauling:

Im Falle des Chlorwasserstoff-Moleküls ist die Elektronegativitätsdifferenz:
ΔEN = 3,0 - 2,1 = 0,9
Ab einer Elektronegativitätsdifferenz von 0,5 spricht man von einer polaren Atombindung.




